
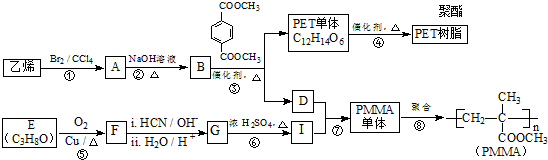
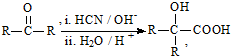 (R、R′代表烃基)
(R、R′代表烃基) .
. .
. .
.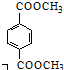 与足量NaOH溶液反应时,最多消耗4molNaOH
与足量NaOH溶液反应时,最多消耗4molNaOH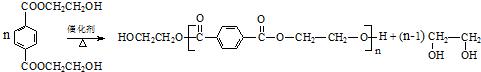 .
. 分析 由PMMA的结构,可知PMMA单体为CH2=C(CH3)COOCH3,则D、I分别为CH2=C(CH3)COOH、CH3OH中的一种,乙烯和溴发生加成反应生成A为CH2BrCH2Br,A在NaOH水溶液、加热条件下发生水解反应生成B为HOCH2CH2OH,根据信息I及PET单体分子式,可知PET单体为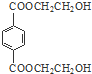 ,则D为CH3OH、I为CH2=C(CH3)COOH,PET单体发生信息I中交换反应进行的缩聚反应生成PET树脂为
,则D为CH3OH、I为CH2=C(CH3)COOH,PET单体发生信息I中交换反应进行的缩聚反应生成PET树脂为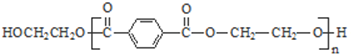 .F发生信息Ⅱ中的反应得到G,G在浓硫酸作用下发生消去反应生成I,则G为
.F发生信息Ⅱ中的反应得到G,G在浓硫酸作用下发生消去反应生成I,则G为 ,故F为
,故F为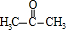 ,E为
,E为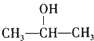 .
.
解答 解:由PMMA的结构,可知PMMA单体为CH2=C(CH3)COOCH3,则D、I分别为CH2=C(CH3)COOH、CH3OH中的一种,乙烯和溴发生加成反应生成A为CH2BrCH2Br,A在NaOH水溶液、加热条件下发生水解反应生成B为HOCH2CH2OH,根据信息I及PET单体分子式,可知PET单体为 ,则D为CH3OH、I为CH2=C(CH3)COOH,PET单体发生信息I中交换反应进行的缩聚反应生成PET树脂为
,则D为CH3OH、I为CH2=C(CH3)COOH,PET单体发生信息I中交换反应进行的缩聚反应生成PET树脂为 .F发生信息Ⅱ中的反应得到G,G在浓硫酸作用下发生消去反应生成I,则G为
.F发生信息Ⅱ中的反应得到G,G在浓硫酸作用下发生消去反应生成I,则G为 ,故F为
,故F为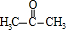 ,E为
,E为 .
.
(1)由上述分析可知,①的反应类型是加成反应,故答案为:加成反应;
(2)②为1,2-二溴乙烷发生水解反应生成乙二醇,该反应的化学方程式为  ,
,
故答案为: ;
;
(3)PMMA单体结构简式为CH2=C(CH3)COOCH3,PMMA单体的官能团名称是碳碳双键和酯基,
故答案为:碳碳双键、酯基;
(4)反应⑤的化学方程式为 ,
,
故答案为: ;
;
(5)G的结构简式为: ,故答案为:
,故答案为: ;
;
(6)
a.⑦是CH2=C(CH3)COOH与CH3OH发生酯化反应生成CH2=C(CH3)COOCH3,故a正确;
b.B为HOCH2CH2OH,D为CH3OH,含有羟基数目本题,二者不是同系物,故b错误;
c.D为CH3OH,分子之间形成氢键,沸点比同碳原子数的烷烃高,故c正确;
d.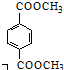 中酯基为羧酸与醇形成的,1mol
中酯基为羧酸与醇形成的,1mol 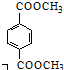 与足量NaOH溶液反应时,最多消耗2molNaOH,故d错误.
与足量NaOH溶液反应时,最多消耗2molNaOH,故d错误.
故选:ac;
(7)由PET单体制备PET聚酯并生成B的化学方程式为: ,
,
故答案为: .
.
点评 本题考查有机物的推断与合成,充分利用给予的信息和有机物的结构进行推断,需要学生熟练掌握官能团的性质与转化,较好的考查学生自学能力、知识迁移运用,难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | B | C | D |
| 乙醇 | 天然气 | 浓硫酸 | 氢氧化钠 |
 |  |  |  |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
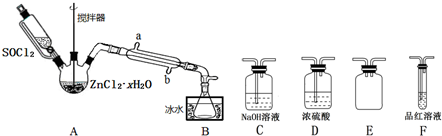
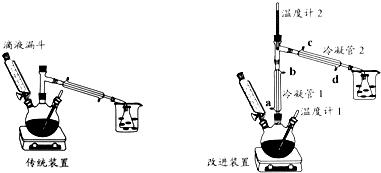
科目:高中化学 来源: 题型:实验题
| 物质 | 熔点℃ | 沸点℃ | 溶解性 | ||
| 水 | 醇 | 醚 | |||
| 浓H2SO4 | 10.35 | 340 | 互溶 | 互溶 | 互溶 |
| 乙醚 | -89.12 | 34.5 | 微溶(在盐溶液中溶解度降低) | 互溶 | 互溶 |
| 乙醇 | -114.5 | 78.4 | 极易溶 | 极易溶 | 极易溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 滴定前滴定管尖嘴有气泡,终点读数时无气泡,则测定结果偏大 | |
| B. | 滴定管用蒸馏水洗涤后,直接装入NaOH溶液进行滴定 | |
| C. | 用酚酞作指示剂,当锥形瓶中溶液由粉红色变无色时停止滴定 | |
| D. | 滴定时两眼应注视滴定管中液面的变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | Ca(HCO3)2与过量NaOH溶液反应:Ca2++HCO3-+OH-═CaCO3↓+H2O | |
| B. | 向AgCl悬浊液中加入KI溶液:AgCl(s)+I-(aq)═AgI(s)+Cl-(aq) | |
| C. | 实验室保存的氯化亚铁溶液在空气中被氧化:4Fe2++O2+4H+═4Fe3++2H2O | |
| D. | 饱和Na2CO3溶液吸收少量HCl尾气:CO32-+2H+═H2O+CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氨和硝酸都是重要的化学品.
氨和硝酸都是重要的化学品.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com