
【题目】有机物A是天然橡胶的单体。有机物F是一种环保型塑料,一种合成路线如图所示:
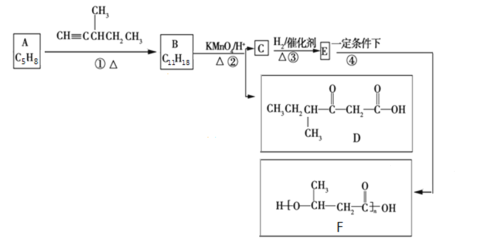
已知:
①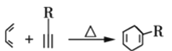
②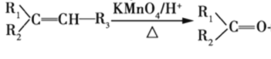 +R3-COOH(—R1、—R2、—R3、—R均为烃基)
+R3-COOH(—R1、—R2、—R3、—R均为烃基)
请回容下列问题:
(1)A用系统命名法命名为__________________________。
(2)A分子与Cl2分子发生1:1加成时,其产物种类有____________种(不考虑立体异构)。
(3)B与足量H2反应后的产物的结构简式为![]() ,则B的结构简式为___________________,1个B分子中有________个手性碳原子。
,则B的结构简式为___________________,1个B分子中有________个手性碳原子。
(4)C分子中的官能团名称为_____________________。
(5)写出反应④的化学方程式:______________________________________________________。
(6)G是C的同分异构体,G能发生水解反应和银镜反应,1个G分子中含有2个碳氧双键,则G的可能结构共有___________种(不考虑立体异构)。
(7)设计由有机物D和甲醇为起始原料制备CH3CH2CH(CH3)CH =CHCOOCH3的合成路线______________(无机试剂任选)。
【答案】2-甲基-1,3-丁二烯 3  1 羰基、羧基 n
1 羰基、羧基 n![]()
![]()
![]()
![]() 7
7 
![]() CH3CH2CH(CH3)CH(OH)CH2COOH
CH3CH2CH(CH3)CH(OH)CH2COOH![]() CH3CH2CH(CH3)CH=CHCOOH
CH3CH2CH(CH3)CH=CHCOOH![]() CH3CH2CH(CH3)CH =CHCOOCH3
CH3CH2CH(CH3)CH =CHCOOCH3
【解析】
根据合成路线可知,E发生缩聚反应生成F,因此E为![]() ,C与H2发生加成反应生成E,由此可知C为CH3COCH2COOH;根据C和D的结构,结合已知条件②可知B的结构为
,C与H2发生加成反应生成E,由此可知C为CH3COCH2COOH;根据C和D的结构,结合已知条件②可知B的结构为 ,有已知条件①和A、B之间的关系可知A和
,有已知条件①和A、B之间的关系可知A和![]() 发生加成反应生成B,由此可知A为
发生加成反应生成B,由此可知A为![]() ,据此进行分析作答。
,据此进行分析作答。
(1)由分析可知A的结构为![]() ,其名称为:2-甲基-1,3-丁二烯;
,其名称为:2-甲基-1,3-丁二烯;
(2) A为![]() ,与氯气发生1:1加成时,可以生成:
,与氯气发生1:1加成时,可以生成: 、
、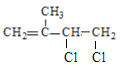 、
、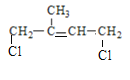 三种有机物;
三种有机物;
(3) B与足量H2反应后的产物的结构简式为![]() ,结合已知条件①可知B的结构简式为:
,结合已知条件①可知B的结构简式为: ,且1个B分子中有1个手性碳原子(标有的碳):
,且1个B分子中有1个手性碳原子(标有的碳):![]() ;
;
(4) C为CH3COCH2COOH,其官能团为羰基和羧基;
(5)E为![]() ,发生缩聚反应生成
,发生缩聚反应生成![]() ,反应方程式为:
,反应方程式为:
n![]()
![]()
![]()
![]() ;
;
(6) C为CH3COCH2COOH,它的同分异构体G能发生水解反应和银镜反应,说明含有酯基和醛基等,且1个G分子中含有2个碳氧双键,G可以是CH3COOCH3、HCOOCH2CH3中H原子被-CHO取代,可形成5种不同的物质,可以是![]() 中H原子被-OOCH取代,或者是CH3CH2CHO中-CHO中H原子被-OOCH取代,因此符合条件的同分异构体共7种;
中H原子被-OOCH取代,或者是CH3CH2CHO中-CHO中H原子被-OOCH取代,因此符合条件的同分异构体共7种;
(7)D为 ,与H2发生加成反应生成CH3CH2CH(CH3)CH(OH)CH2COOH,CH3CH2CH(CH3)CH(OH)CH2COOH在浓硫酸加热的条件下发生消去反应生成CH3CH2CH(CH3)CH=CHCOOH,CH3CH2CH(CH3)CH=CHCOOH与甲醇发生酯化反应生成CH3CH2CH(CH3)CH =CHCOOCH3,具体的合成路线为:
,与H2发生加成反应生成CH3CH2CH(CH3)CH(OH)CH2COOH,CH3CH2CH(CH3)CH(OH)CH2COOH在浓硫酸加热的条件下发生消去反应生成CH3CH2CH(CH3)CH=CHCOOH,CH3CH2CH(CH3)CH=CHCOOH与甲醇发生酯化反应生成CH3CH2CH(CH3)CH =CHCOOCH3,具体的合成路线为:
![]() CH3CH2CH(CH3)CH(OH)CH2COOH
CH3CH2CH(CH3)CH(OH)CH2COOH![]() CH3CH2CH(CH3)CH=CHCOOH
CH3CH2CH(CH3)CH=CHCOOH![]() CH3CH2CH(CH3)CH =CHCOOCH3。
CH3CH2CH(CH3)CH =CHCOOCH3。


科目:高中化学 来源: 题型:
【题目】煤粉中的氮元素在使用过程中的转化关系如图所示:

(1)②中NH3参与反应的化学方程式为_______。
(2)焦炭氮中有一种常见的含氮有机物吡啶(![]() ),其分子中相邻的C和N原子相比,N原子吸引电子能力更___________(填“强”或“弱”),从原子结构角度解释原因:________。
),其分子中相邻的C和N原子相比,N原子吸引电子能力更___________(填“强”或“弱”),从原子结构角度解释原因:________。
(3)工业合成氨是人工固氮的重要方法。2007年化学家格哈德·埃特尔证实了氢气与氮气在固体催化剂表面合成氨的反应过程,示意如图:
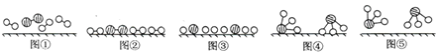
下列说法正确的是________(选填字母)。
a. 图①表示N2、H2分子中均是单键
b. 图②→图③需要吸收能量
c. 该过程表示了化学变化中包含旧化学键的断裂和新化学键的生成
(4)已知:N2(g) + O2(g) = 2NO(g) ΔH = a kJ·mol-1
N2(g) + 3H2(g) = 2NH3(g) ΔH = b kJ·mol-1
2H2(g) + O2(g) = 2H2O(l) ΔH = c kJ·mol-1
反应后恢复至常温常压,①中NH3参与反应的热化学方程式为________。
(5)用间接电化学法除去NO的过程,如图所示:

①已知电解池的阴极室中溶液的pH在4~7之间,写出阴极的电极反应式:________。
②用离子方程式表示吸收池中除去NO的原理:__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X(g)+3Y(g)![]() 2Z(g) ΔH=-akJ·mol-1,一定条件下,将1molX和3molY通入2L的恒容密闭容器中,反应10min,测得Y的物质的量为2.4mol。下列说法正确的是
2Z(g) ΔH=-akJ·mol-1,一定条件下,将1molX和3molY通入2L的恒容密闭容器中,反应10min,测得Y的物质的量为2.4mol。下列说法正确的是
A.10min内,Y的平均反应速率为0.03mol·L-1·s-1
B.第10min时,X的反应速率为0.01mol·L-1·min-1
C.10min内,消耗0.2molX,生成0.4molZ
D.10min内,X和Y反应放出的热量为akJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
教材插图具有简洁而又内涵丰富的特点。请回答以下问题:
(1)第三周期的某主族元素,其第一至第五电离能数据如图1所示,则该元素对应的原子有_____种不同运动状态的电子。
(2)如图2所示,每条折线表示周期表ⅣA ~ⅦA 中的某一族元素氢化物的沸点变化。每个小黑点代表一种氢化物,其中a点代表的是___________。判断依据是____________。
(3)CO2在高温高压下所形成的晶体其晶胞如图3所示。则该晶体的类型属于_____________晶体。

(4)第一电离能介于Al、P之间的第三周期元素有____种。 GaCl3中中心原子的杂化方式为_________,写出与GaCl3结构相同的一种等电子体(写离子)______________。
(5)冰、干冰、碘都是分子晶体,冰的结构具有特殊性,而干冰、碘的晶体具有相似的结构特征,干冰分子中一个分子周围有__________个紧邻分子。 D的醋酸盐晶体局部结构如图,该晶体中含有的化学键是_____________(填字母标号)。

a.极性键 b.非极性键 c.配位键 d.金属键
(6)Fe的一种晶体如甲、乙所示,若按甲虚线方向切乙得到的A~D图中正确的是_____(填字母标号)。


铁原子的配位数是____________,假设铁原子的半径是r cm,该晶体的密度是ρg/cm3 ,则铁的相对原子质量为________________(设阿伏加德罗常数的值为NA)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生用如图所示装置做浓硫酸和蔗糖反应的实验。下列有关实验操作或叙述错误的是( )
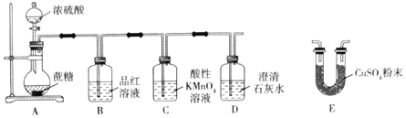
A.打开A中分液漏斗活塞,加入浓硫酸,充分反应后烧瓶内出现黑色膨化固体
B.品红溶液红色褪去,证明有SO2气体生成
C.检验A中产生的气体中含有水蒸气,应将E接在A和B之间
D.D中溶液变浑浊,即可证明反应产生了CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 (1)如图所示,若溶液C为浓硝酸,电流表指针发生偏转,B电极材料为Fe,A电极材料为Cu,则B电极的电极反应式为_________,A电极的电极反应式为____________;反应进行一段时间后溶液C的酸性会____(填“增强”“减弱”或“基本不变”)。
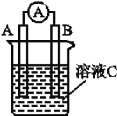
(2)我国首创以铝—空气—海水电池作为能源的新型海水标志灯,以海水为电解质溶液,靠空气中的氧气使铝不断氧化而产生电流,只要把灯放入海水数分钟,就会发出耀眼的白光。则电源的负极材料是______(填化学名称),负极反应为___________;正极反应为_________。
(3)熔融盐电池具有高的发电效率,因而受到重视。可用Li2CO3和Na2CO3的熔融盐混合物作电解质,CO为负极燃气,空气与CO2的混合气为正极助燃气,制得在650 ℃下工作的燃料电池,其负极反应式为2CO+2CO32---4e-![]() 4CO2,则正极反应式为_____,电池总反应式为______。
4CO2,则正极反应式为_____,电池总反应式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知NH4NO3的分解产物与温度有关:
NH4NO3![]() NH3↑+HNO3↑①
NH3↑+HNO3↑①
NH4NO3![]() N2O↑+2H2O↑②
N2O↑+2H2O↑②
2NH4NO3![]() 2N2↑+O2↑+4X↑③
2N2↑+O2↑+4X↑③
4NH4NO3![]() 3N2↑+2NO2↑+8H2O↑④
3N2↑+2NO2↑+8H2O↑④
下列说法错误的是
A.四个反应中有三个是氧化还原反应
B.反应②所得混合气体的相对分子质量是26.7
C.反应③中X的化学式是H2O
D.反应④的氧化产物是N2,还原产物是NO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢气在氧气中燃烧产生淡蓝色火焰。在反应过程中,破坏1 mol氢气中的化学键消耗的能量为Q1kJ,破坏1 mol氧气中的化学键消耗的能量为Q2KJ,形成1 mol水中的化学键释放的能量为Q3kJ。下列关系式中正确的是
A.2Q1+Q2 <2Q3B.Q1+Q2>Q3C.Q1+Q2< Q3D.Q1+Q2> 2Q3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷酸铁(FePO4)常用作电极材料、陶瓷及制药等。以硫铁矿(主要成分是FeS2及少量SiO2、Fe3O4)为原料制备磷酸铁的流程如下:
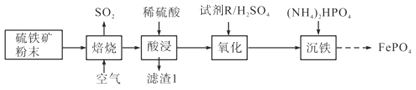
(1)焙烧时FeS2转化为Fe2O3,该反应中氧化剂与还原剂物质的量之比为___________。
(2)“酸浸”时为加速溶解,采取的措施有_________________________________(任写两种)。
(3)滤渣1是___________。
(4)氧化步骤是将少量的Fe2+转化为Fe3+,试剂R最好选择___________(填字母)。
A.KMnO4 B.H2O2 C.稀硝酸
(5)写出沉铁时反应的离子方程式______________________________________________。
(6)1 t硫铁矿中含FeS2 a mol、Fe3O4 b mol,按上述流程生成c t的FePO4,则FePO4的产率为__________________。(用含a、b、c的算式表示,不必化简)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com