
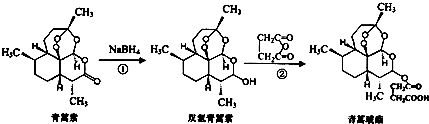
| A. | 青蒿素分子式为C15H22O5 | |
| B. | 青蒿素不能与NaOH溶液反应 | |
| C. | 反应②原子利用率为100% | |
| D. | 青蒿琥酯能与氢氧化钠溶液反应可生成青蒿琥酯钠 |
分析 A.根据结构简式确定分子式;
B.青蒿素中含有酯基和醚键,酯基能和NaOH反应;
C.加成反应时原子利用率为100%;
D.青蒿琥酯能与氢氧化钠溶液反应时,酯基水解生成羧酸钠和醇羟基.
解答 解:A.根据结构简式知,其分子式为C15H22O5,故A正确;
B.青蒿素中含有酯基和醚键,酯基能和NaOH发生水解反应,故B错误;
C.反应②为加成反应,原子利用率为100%,故C正确;
D.青蒿琥酯能与氢氧化钠溶液反应时,酯基水解生成羧酸钠和醇羟基,所以得不到青蒿琥酯钠,故D错误;
故选AC.
点评 本题考查有机物结构和性质,为高频考点,侧重考查羧酸、酯基及加成反应,明确官能团及其性质关系是解本题关键,易错选项是D.


 开心蛙状元测试卷系列答案
开心蛙状元测试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 大多数化学反应在一定条件下都有一定的限度 | |
| B. | 当可逆反应达到反应限度时,反应会自动停止 | |
| C. | 使用催化剂,可降低反应的活化能,加快反应速率,改变反应限度 | |
| D. | FeCl3与KSCN反应达到平衡时,向其中加少量KCl固体,则溶液颜色变深 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下水电离出c(H+)×c(OH-)=10-20的溶液中:Na+、ClO-、SO42-、NH4+能大量共存 | |
| B. | 常温下pH=7的溶液中:Fe3+、Mg2+、SO42-、Cl-能大量共存 | |
| C. | 一定温度下,l L 0.5 mol•L-1NH4Cl溶液与2 L 0.25 mol•L-1NH4Cl溶液含NH4+物质的量相同 | |
| D. | 反应ZnS(s)+Cu2+(aq)=CuS(s)+Zn2+(aq)说明Ksp(ZnS)>Ksp(CuS) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(A)=30mol•L-1•min-1 | B. | v(B)=0.3mol•L-1•s-1 | ||
| C. | v(C)=48mol•L-1•min-1 | D. | v(D)=1mol•L-1•s-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④ | B. | ③④ | C. | ①③④ | D. | 全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 不慎把浓硫酸粘在手上,立即用大量的水冲洗,涂上3%-5%的碳酸氢钠溶液 | |
| B. | 如果汽油、煤油等可燃物着火,应立即用沙土扑灭 | |
| C. | 不慎将浓碱沾到皮肤上,立即用大量的水冲洗,然后涂上硼酸溶液 | |
| D. | 酒精灯不慎碰翻着火,应立即用湿布盖灭 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .试写出由上述元素组成的分子中含有4个原子核且为18电子结构的物质的化学式H2O2
.试写出由上述元素组成的分子中含有4个原子核且为18电子结构的物质的化学式H2O2查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com