(2011?丰台区一模)工业生产中含硫废水的排放会污染环境,需要对含硫废水进行处理与利用.
(1)某制革厂含硫废水中主要含有物是Na
2S.
①测得该废水溶液pH=12,用离子方程式解释溶液呈碱性的原因
S
2-+H
2O

HS
-+OH
-S
2-+H
2O

HS
-+OH
-.
②含硫废水的处理过程中可以采用纯氧将Na
2S转化为Na
2SO
4,则反应中还原剂与氧化剂的物质的量之比为
1:2
1:2
.已知1000℃时,硫酸钠与氢气发生下列反应:Na
2SO
4(s)+4H
2(g)?Na
2S(s)+4H
2O(g),已知该反应的平衡常数K
1000℃<K
1400℃,则该反应的△H
>
>
0(填“>”“=”或“<”).
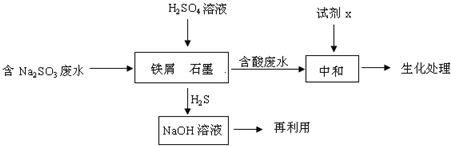
(2)含硫燃料中间体废水中主要含有物为Na
2SO
3,回收废水中的硫化物,以减少资源的浪费,可采用以下方法:
①中和含酸废水工业常用的试剂x是
石灰水
石灰水
.
②写出H
2S气体与足量NaOH溶液反应的化学方程式
H2S+2NaOH=Na2S+2H2O
H2S+2NaOH=Na2S+2H2O
.
③铁屑与石墨能形成微型原电池,SO
32-在酸性条件下放电生成H
2S进入气相从而达到从废水中除去Na
2SO
3的目的,写出SO
32-在酸性条件下放电生成H
2S的电极反应式:
SO32-+8H++6e-=H2S↑+3H2O
SO32-+8H++6e-=H2S↑+3H2O
.
④已知:2H
2S(g)+O
2(g)=2S(s)+2H
2O(l)△H=-632.8kJ/mol
SO
2(g)=S(s)+O
2(g)△H=+269.8kJ/mol
H
2S与O
2反应生成SO
2和H
2O的热化学方程式为
2H2S(g)+3O2(g)=2SO2(g)+2H2O(l)△H=-1172.4kJ/mol
2H2S(g)+3O2(g)=2SO2(g)+2H2O(l)△H=-1172.4kJ/mol
.

 HS-+OH-
HS-+OH- HS-+OH-
HS-+OH-
 HS-+OH-,
HS-+OH-, HS-+OH-;
HS-+OH-;

 (2011?丰台区一模)常温下,用0.1000mol/L NaOH溶液分别滴定20.00mL 0.1000mol/L 盐酸和20.00mL 0.1000mol/L 醋酸溶液,得到2条滴定曲线,如图所示.若以HA表示酸,下列说法正确的是( )
(2011?丰台区一模)常温下,用0.1000mol/L NaOH溶液分别滴定20.00mL 0.1000mol/L 盐酸和20.00mL 0.1000mol/L 醋酸溶液,得到2条滴定曲线,如图所示.若以HA表示酸,下列说法正确的是( )