
| 元素代号 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
| 原子半径(nm) | 0.186 | 0.160 | 0.152 | 0.153 | 0.110 | 0.099 | 0.075 | 0.074 |
| 主要化合价 | +1 | +2 | +1 | +3 | +5、 -3 | +7、 -1 | +5、 -3 | -2 |
 .
.分析 第二、三周期元素中,①③均有+1价,处于IA族,原子半径①>③,则①为Na、③为Li;⑤⑦均有+5、-3价,原子半径⑤>⑦,则⑤为P元素、⑦为N元素;②有+2价,处于ⅡA族,原子半径大于P,故②为Mg;③有+3价,处于ⅢA族,原子半径大于P,故③为Al;⑥有+7、-1价,则⑥为Cl;⑧有-2价,处于VIA族,原子半径小于氯,故⑧为O元素.
解答 解:(1)第二、三周期元素中,①③均有+1价,处于IA族,原子半径①>③,则①为Na、③为Li;⑤⑦均有+5、-3价,原子半径⑤>⑦,则⑤为P元素、⑦为N元素;②有+2价,处于ⅡA族,原子半径大于P,故②为Mg;③有+3价,处于ⅢA族,原子半径大于P,故③为Al;⑥有+7、-1价,则⑥为Cl;⑧有-2价,处于VIA族,原子半径小于氯,故⑧为O元素,
故答案为:Na;Mg;Li;Al;P;Cl;N;O;
(2)⑧为O元素,在元素周期表中的位置是:第二周期VIA族,
故答案为:第二周期VIA族;
(3)8个元素的最高价氧化物的水化物中,酸性最强的是HClO4,
故答案为:HClO4;
(4)①元素和⑥元素形成化合物为NaCl,电子式是 ,
,
故答案为: ;
;
(5)④最高价氧化物对应水化物为Al(OH)3,⑥的氢化物水溶液为盐酸,二者反应的离子方程式:Al(OH)3+3H+=Al3++3H2O,
故答案为:Al(OH)3+3H+=Al3++3H2O;
(6)A.③为Li,处于第二周期,④为Al,处于第三周期,故A正确;
B.②的阳离子核外电子数为10、⑧的阴离子的核外电子数为10,故B正确;
C.在同主族元素中F元素非金属性比Cl的强,故C错误;
D.⑤为P元素、⑦为N元素,两者核电荷数之差是8,故D正确;
E.①与⑧形成的化合物为氧化钠、过氧化钠,不是两性氧化物,故E错误.
故选:ABD.
点评 本题考查结构性质位置关系应用,关键是根据原子半径与化合价推断元素,注意对元素周期律的理解掌握.


科目:高中化学 来源: 题型:选择题
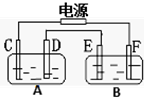
| A. | A池为电解池,B池为原电池 | B. | D、E两极都发生氧化反应 | ||
| C. | F极应为纯铜板材料 | D. | B池中E极质量增加12.8g |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
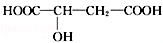 .请回答:
.请回答:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定浓度氢氧化钠溶液的配制(托盘天平、烧杯、温度计) | |
| B. | 蛋白质的盐析(试管、醋酸铅溶液、鸡蛋白溶液) | |
| C. | 钠的焰色反应(铂丝、氯化钠溶液、稀盐酸) | |
| D. | 乙酸的酯化反应实验(酒精灯、浓硫酸、浓盐酸) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②④⑥⑦ | B. | ④⑥ | C. | ①④⑤⑧ | D. | ①②④⑤⑥⑦ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com