
X、Y、Z、M、N代表五种金属,有以下化学反应:
(1)水溶液中:X+Y2+=X2++Y;
(2)Z+2 H2O(冷水)=Z(OH) 2+H2↑
(3)M、N 为电极,与N盐溶液组成原电池,电极反应为:M-2e-=M2+
(4)Y 可以溶于稀硫酸中,M不被稀硫酸氧化。则这五种金属的活泼性由弱到强的顺序是
A.M<N<Y<X<Z B.N<M<X<Y<Z
C.N<M<Y<X<Z D.X<Z<N<M<Y
 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案科目:高中化学 来源:2016-2017学年山西省高二12月月考化学试卷(解析版) 题型:选择题
室温下,下列溶液等体积混合后,所得溶液的pH一定大于7的是
A.0.1 mol/L的盐酸和0.1 mol/L的氢氧化钠溶液
B.0.1 mol/L的硫酸和0.1 mol/L的氢氧化钡溶液
C.pH=4的醋酸溶液和pH=10的氢氧化钠溶液
D.pH=4的醋酸溶液和pH=10的氨水溶液
查看答案和解析>>
科目:高中化学 来源:2016-2017学年内蒙古高一期中化学卷(解析版) 题型:选择题
甲、乙、丙、丁分别是氢氧化钙溶液、硝酸钾溶液、碳酸钠溶液、盐酸中的一种。已知甲和丙可以反应,甲和丁也可以反应,则下列说法正确的是
 A.甲一定是氢氧化钙溶液 B.乙一定是硝酸钾溶液
A.甲一定是氢氧化钙溶液 B.乙一定是硝酸钾溶液
C.丙不可能是碳酸钠溶液 D.丁只能是盐酸
查看答案和解析>>
科目:高中化学 来源:2016-2017学年内蒙古高一期中化学卷(解析版) 题型:选择题
氧化还原反应的实质是
A.分子中的原子重新组合 B.氧元素的得失
C.电子的得失或共用电子对的偏移 D.化合价的改变
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江西省高二上段考二化学试卷(解析版) 题型:填空题
己知可逆反应AsO43-+2I-+2H+ AsO33-+I2+H2O,设计如下图装置,进行下述操作:
AsO33-+I2+H2O,设计如下图装置,进行下述操作:
①向(Ⅱ)烧杯中逐滴加入浓盐酸,发现微安表(G)指针偏转;②若改往(Ⅱ)烧杯中滴加40%NaOH溶液,发现微安表指针与①的偏转方向相反。回答下列问题

(1)操作①过程中,C1棒为__________极,C2棒上发生的反应为______________________
(2)操作②过程中盐桥中的_________离子移向(I)烧杯,C1棒上发生的反应为_____________
(3)若将微安表换成电解冶炼铝装置,写出电解总反应方程式__________________________________
(4)若将微安表换成电解精炼铜装置,在操作②过程中与C2棒连接的为_________电极,电解一段时间后,溶液中CuSO4溶液的浓度_____________(填“变大”“变小”或“不变”)
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江西省高二上段考二化学试卷(解析版) 题型:选择题
用0.1000mol·L-1NaOH溶液滴定未知浓度的盐酸,选用酚酞为指示剂,造成测定结果偏高的原因可能是
A.盛装待测液的锥形瓶用蒸馏水洗过,没用待测液润洗
B.酸式滴定管在使用前未用待测液盐酸润洗
C.滴定前碱式滴定管尖嘴中有气泡,滴定后气泡消失
D.滴定前读数平视,滴定终点读数时俯视碱式滴定管的刻度
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江西省高二上段考二化学试卷(解析版) 题型:选择题
电池是人类生产和生活的重要能量来源,各式各样电池的发展是化学对人类的一项重大贡献。下列有关电池的叙述正确的是
A.锌锰干电池工作一段时间后碳棒变细
B.氢氧燃料电池可将热能直接转变为电能
C.在现实生活中,电化学腐蚀要比化学腐蚀严重的多,危害更大
D.太阳能电池的主要材料是高纯度的二氧化硅
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省高二11月月考化学试卷(解析版) 题型:选择题
己知NA是阿伏加徳罗常数,下列说法正确的是( )
A. 7.lg氯气与足量的氢氧化钠溶液反应转移的电子数为0.2NA
B. V L amol/L的氯化铁溶液中,若Fe3+的数目为NA,则Cl-的数目大于3NA
C. 标准状况下,22.4LNO和11.2LO2混合后气体的分子总数为1.0NA
D. 工业用电解法进行粗铜精炼时,毎转移lmol电子,阳极上溶解的铜原子数必为0.5NA
查看答案和解析>>
科目:高中化学 来源:2017届福建省高三上学期期中化学试卷(解析版) 题型:填空题
钛、铬、铁、镍、铜等金属及其化合物在工业上有重要用途。
(1)钛铁合金是钛系储氢合金的代表,该合金具有放氢温度低、价格适中等优点。
①Ti的基态原子价电子排布式为________________。
②Fe的基态原子共有________种不同能级的电子。
(2)制备CrO2Cl2的反应为K2Cr2O7+3CCl4===2KCl+2CrO2Cl2+3COCl2↑。
①上述化学方程式中非金属元素电负性由大到小的顺序是______________(用元素符号表示)。
②COCl2分子中所有原子均满足 8电子构型,COCl2分子中σ键和π键的个数比为____________,中心原子的杂化方式为____________。
8电子构型,COCl2分子中σ键和π键的个数比为____________,中心原子的杂化方式为____________。
(3)NiO、FeO的晶体结构均与氯化钠的晶体结构相同,其中Ni2+和Fe2+的离子半径分别为6.9×10-2 nm和7.8×10-2 nm。则熔点:NiO____________(填“>”、“<”或“=”)FeO。
(4)Ni和La的合金是目前使用广泛的储氢材料,具有大容量、高寿命、耐低温等特点,在日本和中国已实现了产业化。该合金的晶胞结构如图所示。
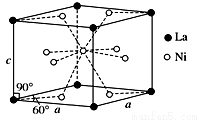
①该晶体的化学式为________________。
②已知该晶胞的摩尔质量为M g·mol-1,密度为d g·cm-3。设NA为阿伏加德罗常数的值,则该晶胞的体积是____________cm3(用含M、d、NA的代数式表示)。
[化学—选修5:有机化学基础]
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com