
分析 (1)①4NH3(g)+5O2(g)═4NO(g)+6H2O(g)△H1=-907.28kJ•mol-1;②4NH3(g)+3O2(g)═2N2(g)+6H2O(g)△H2=-1 269.02kJ•mol-1;目标反应的反应热为:$\frac{②×5-①×3}{2}$,由此分析解答;
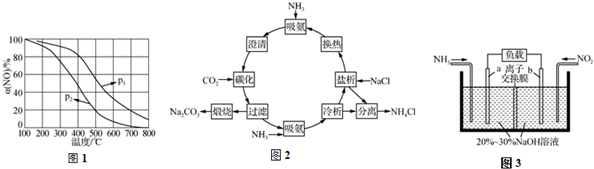
②温度相同时p1的一氧化氮的氮率大,所以增大压强平衡正向移动;α(NO)几乎为0的原因是无二氧化氮,NO2几乎完全分解;
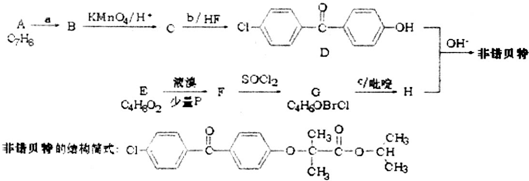
(2)联合制碱工艺示意图如图2所示,“碳化”时发生反应的化学方程式为CO2+NH3+H2O+NaCl═NaHCO3↓+NH4C1;
(3)电极b的电极发生还原反应,二氧化氮转化生成氮气,电极反应式为2NO2+8e-+4H2O═8OH-+N2;标准状况下4.48L NH3的物质的量为:0.2mol,根据4NH3~3NO2进行计算;
(4)NaHS再与NaVO3反应生浅黄色沉淀是硫单质和Na2V4O9,根据得失电子守恒,得化学方程式为:2NaHS+4NaVO3+H2O═Na2V4O9+2S↓+4NaOH.
解答 解:(1)①4NH3(g)+5O2(g)═4NO(g)+6H2O(g)△H1=-907.28kJ•mol-1;②4NH3(g)+3O2(g)═2N2(g)+6H2O(g)△H2=-1 269.02kJ•mol-1;目标反应的反应热为:$\frac{②×5-①×3}{2}$=1811.63 kJ•mol-1,故答案为:-1811.63 kJ•mol-1;
②温度相同时p1的一氧化氮的氮率大,所以增大压强平衡正向移动,所以p1>p2;α(NO)几乎为0的原因是无二氧化氮,NO2几乎完全分解;故答案为:>;NO2几乎完全分解;
(2)(2)联合制碱工艺示意图如图2所示,“碳化”时发生反应的化学方程式为CO2+NH3+H2O+NaCl═NaHCO3↓+NH4C1,故答案为:CO2+NH3+H2O+NaCl═NaHCO3↓+NH4C1;
(3)电极b的电极发生还原反应,二氧化氮转化生成氮气,电极反应式为2NO2+8e-+4H2O═8OH-+N2;标准状况下4.48L NH3的物质的量为:0.2mol,根据4NH3~3NO2,所以被消除的NO2的物质的量为$\frac{3}{4}×0.2$=0.15mol,故答案为:2NO2+8e-+4H2O═8OH-+N2;0.15;
(4)NaHS再与NaVO3反应生浅黄色沉淀是硫单质和Na2V4O9,根据得失电子守恒,得化学方程式为:2NaHS+4NaVO3+H2O═Na2V4O9+2S↓+4NaOH,故答案为:2NaHS+4NaVO3+H2O═Na2V4O9+2S↓+4NaOH.
点评 本题考查盖斯定律的应用、依据图象分析平衡移动的原因、及电极反应式书写,考查范围广,易错题为(3)题,会根据化合价的变化确定NO2的电极,然后书写电极反应式.


科目:高中化学 来源: 题型:解答题
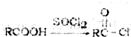
 ,F
,F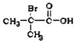 .
.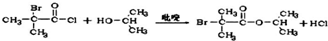 .
.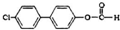 .
.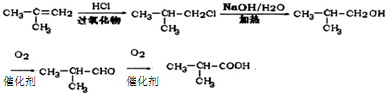 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向稀的苯酚水溶液中滴加少量稀溴水,先看到白色沉淀后沉淀消失,因为生成的三溴苯酚又溶于苯酚溶液中 | |
| B. | 向浓度均为0.1mol/L的MgCl2、CuCl2混合溶液中逐滴加入氨水,先出现蓝色沉淀,因为KSP[Mg(OH)2]>KSP[Cu(OH)2] | |
| C. | 利用以下实验器材(规格数量不限):烧杯、量筒、环形玻璃搅拌棒、纸条、硬纸板、温度计能完成中和反应反应热的测定 | |
| D. | 将实验室制乙烯的发生装置中制得的产物直接通入酸性高锰酸钾溶液,溶液褪色则说明乙烯有还原性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子式为C3H6的有机物只有两种同分异构体 | |
| B. | 标准状况下,22.4 L CCl4的质量为154 g | |
| C. | 选用适当的催化剂,既可以改变化学反应速率,也可以改变反应物的平衡转化率 | |
| D. | 2 g H2(g)在O2(g)中完全燃烧生成H2O(l)放出热量为285.8 kJ,则该反应的热化学方程式可表示为:2H2(g)+O2(g)═2H2O(l)△H=-285.8 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
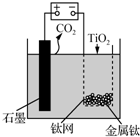 用如图所示装置(熔融CaF2-CaO作电解质)获得金属钙,并用钙还原TiO2制备金属钛.下列说法正确的是( )
用如图所示装置(熔融CaF2-CaO作电解质)获得金属钙,并用钙还原TiO2制备金属钛.下列说法正确的是( )| A. | 电解过程中,Ca2+向阳极移动 | |
| B. | 阳极的电极反应式为:C+2O2--4e-═CO2↑ | |
| C. | 在制备金属钛前后,整套装置中CaO的总量减少 | |
| D. | 若用铅蓄电池作该装置的供电电源,“+”接线柱是Pb电极 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 不能判断溶液中是否存在SO42- | |
| B. | 溶液中一定不存在的离子是CO${\;}_{3}^{2-}$ | |
| C. | 不能判断溶液中是否存在Ag+ | |
| D. | 不能判断是否含有 AlO2- 离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一旦将氨气用作燃料,将彻底解决能源危机 | |
| B. | 氨气燃烧的化学方程式可能为4NH3+5O2$\frac{\underline{\;点燃\;}}{\;}$4NO+6H2O | |
| C. | 比氢气更易储存,因为氨易液化 | |
| D. | 在氨燃料电池中,氨作正极 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com