
 及物质的构成来分析;
及物质的构成来分析; 2FeCl3,不一定是在标准状况下,由氯气的体积无法计算其物质的量.
2FeCl3,不一定是在标准状况下,由氯气的体积无法计算其物质的量.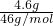 ×3NAmol-1=0.3NA,若全为N2O4,原子数为
×3NAmol-1=0.3NA,若全为N2O4,原子数为 ×6NAmol-1=0.3NA,则4.6gNO2和N2O4中含有的原子数为0.3NA,故A正确;
×6NAmol-1=0.3NA,则4.6gNO2和N2O4中含有的原子数为0.3NA,故A正确; 2FeCl3,1.5mol氯气反应转移的电子数为3NA,但气体不一定在标准状况下,由氯气的体积无法计算其物质的量,故D错误;
2FeCl3,1.5mol氯气反应转移的电子数为3NA,但气体不一定在标准状况下,由氯气的体积无法计算其物质的量,故D错误;

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com