
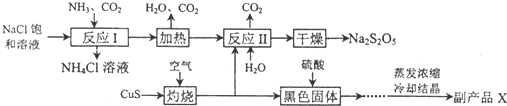
分析 反应Ⅰ为生成NaHCO3,加热生成Na2CO3,在反应Ⅱ中二氧化硫与碳酸钠反应生成NaHSO3与二氧化碳,加热NaHSO3生成Na2S2O5,
(1)根据流程确定反应物为NaCl、NH3、CO2,产物为NH4Cl和碳酸氢钠;反应Ⅰ进行时应先通入氨气,增大HCO3-的浓度,便于NaHCO3析出;氯化铵常用作氮肥;
(2)CuS与氧气反应生成黑色氧化铜和二氧化硫气体,根据化学方程式可计算出转移电子的物质的量;
(3)Na2S2O5中硫元素的化合价为+4价,生成二氧化硫化合价没变;
(4)氧化铜与硫酸反应生成硫酸铜,结晶得出硫酸铜晶体;根据流程图可知,可循环使用的物质是二氧化碳;
(5)反应Ⅱ中反应应是二氧化硫与碳酸钠反应生成NaHSO3,NaHSO3再生成Na2S2O5,反应方程式为Na2CO3+2 SO2+H2O=2NaHSO3+CO2,为了控制杂质,二氧化硫与碳酸氢钠应按反应方程式中比例关系反应;检验产品中含有碳酸钠杂质,需加酸反应检验二氧化碳生成,即用的澄清石灰水,但加酸会生成二氧化硫,二氧化硫也能使澄清石灰水变浑浊,故应先除去,用酸性高锰酸钾溶液根据颜色不褪色确定二氧化硫除净,据此答题.
解答 解:(1)流程确定反应物为NaCl、NH3、CO2,产物为NH4Cl和碳酸氢钠,反应Ⅰ的化学方程式为:NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl,反应Ⅰ进行时应先通入氨气,增大HCO3-的浓度,便于NaHCO3析出,氯化铵常用作氮肥,
故答案为:NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl;NH3;氮肥;
(2)硫化铜灼烧一定生成氧化铜和二氧化硫,反应的化学方程式为:2CuS+3O2 $\frac{\underline{\;高温\;}}{\;}$2CuO+2SO2,在该反应中每产生2mol二氧化硫则转移12mol电子,所以生成SO21.12×l06 L(标准状况下)即5×l04 mol,则转移电子3×l05 mol
故答案为:2CuS+3O2 $\frac{\underline{\;高温\;}}{\;}$2CuO+2SO2;3×l05;
(3)根椐提示可知生成二氧化硫和水,Na2S2O5与稀硫酸反应放出SO2和水,反应的离子方程式为S2O52-+2H+=2SO2↑+H2O,
故答案为:S2O52-+2H+=2SO2↑+H2O;
(4)上述分析可知,氧化铜与硫酸反应生成硫酸铜,蒸发浓缩,冷却结晶,过滤洗涤,得出硫酸铜晶体,副产品X的化学式是CuSO4•5H2O,根据流程图可知,可循环使用的物质是CO2,
故答案为:CuSO4•5H2O;CO2;
(5)从生产过程可以看出是硫酸铜晶体;从图示中可以看出二氧化碳和水可以再次利用,反应Ⅱ中气体与固体分别是二氧化硫和碳酸钠,这两种物质反应必须生成亚硫酸氢钠:反应Ⅱ中反应应是二氧化硫与碳酸钠反应生成NaHSO3,NaHSO3再生成Na2S2O5,反应方程式为Na2CO3+2SO2+H2O=2NaHSO3+CO2,因此气体与固体的物质的量之比为:2:1,检验产品中含有碳酸钠杂质,需加酸反应检验二氧化碳生成,即用的澄清石灰水,但加酸会生成二氧化硫,二氧化硫也能使澄清石灰水变浑浊,故应先除去,用酸性高锰酸钾溶液根据颜色不褪色确定二氧化硫除净,故选①④⑤,
故答案为:2:1;①④⑤.
点评 本题考查了物质置制备的实验方案分析,主要是物质性质的理解应用,离子方程式书写方法,注意试剂的选择和实验操作的目的,掌握基础是解题关键,题目难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 用水鉴别炭粉和二氧化锰 | |
| B. | 用闻气味的方法鉴别白酒和白醋 | |
| C. | 用澄清石灰水鉴别氮气和二氧化碳 | |
| D. | 用相互刻画的方法鉴别黄铜片和铜片 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
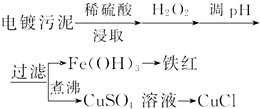
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
| 开始沉淀的pH | 2.3 | 7.6 | 4.4 |
| 完全沉淀的pH | 3.2 | 9.7 | 6.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验步骤 | 实验操作 | 实验现象 |
| Ⅰ | 将反应后的黑色粉末X(假定成分分布均匀)取出少量,放入另一试管中,加入少量盐酸,微热 | 黑色粉末逐渐溶解,溶液呈浅绿色;有少量气泡产生 |
| Ⅱ | 向实验Ⅰ中得到的溶液滴加几滴KSCN溶液,振荡 | 溶液没有出现红色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
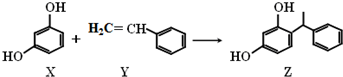
| A. | X、Y和Z均能与溴水发生反应,其中X、Z发生取代反应,Y发生加成反应 | |
| B. | X和Z均能NaOH溶液反应,也能与NaHCO3溶液反应放出CO2 | |
| C. | Y既能与H2发生加成反应,也能使酸性高锰酸钾溶液褪色 | |
| D. | Y可作加聚反应单体,X可作缩聚反应单体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | vA=0.15mol•L-1•min-1 | B. | vB=0.6mol•L-1•min-1 | ||
| C. | vC=0.35mol•L-1•min-1 | D. | vD=0.02mol•L-1•s-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 滴入KMnO4溶液的次序 | KMnO4溶液紫色褪去所需的时间 |
| 先滴入第1滴 | 60s |
| 褪色后,再滴入第2滴 | 15s |
| 褪色后,再滴入第3滴 | 3s |
| 褪色后,再滴入第4滴 | 1s |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com