
【题目】Ni2O3是灰黑色、有光泽的固体,主要用作陶瓷、搪瓷和玻璃的着色颜料,也可用于制备镍粉。以废镍料为原料提取Ni2O3的工艺流程如图所示。

请回答下列问题:
(1)镍的某种化合物NiOOH,其中Ni的化合价为___________。
(2)加入双氧水“氧化”的离子方程式为____________________;滤渣A的主要成分是________________(填化学式)。
(3)步骤①中为了控制“氧化”效率,最佳物质的量之比NaOH/NaClO =________。
(4)步骤②电解法制取Ni2O3,用NaOH调酸溶后溶液的pH至7.5,加入适量Na2SO4后以惰性电极电解。电解过程中产生的Cl2有约40%在弱碱性条件下生成ClO-,再把二价镍氧化为三价镍。加入Na2SO4的作用__________________________;当有n mol二价镍全部转化为三价镍时,外电路中通过电子的物质的量约为____________。
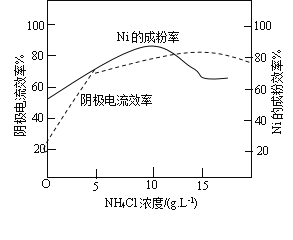
(5)工业上,镍作阳极,电解0.1molL-1NiCl2溶液与一定量NH4Cl溶液组成的混合溶液,可得到高纯度、球形的超细镍粉。当其他条件一定时,NH4Cl的浓度对阴极电流效率(电极上实际沉积的物质的量与理论析出量之比)及Ni的成粉的影响如图所示。
① 为获得高纯度的球形超细镍粉,NH4Cl溶液的浓度最好控制为__________gL-1。
② 当NH4Cl浓度大于15gL-1时,阴极有气体生成,导致阴极电流效率降低,请结合平衡移动原理解释其原因____。
【答案】+3 2Fe2++2H++H2O2=2Fe3++2H2O Fe(OH)3 4 : 1(或4) 增强溶液的导电性 2.5n mol 10 随着NH4Cl溶液浓度增大,NH4++H2O![]() NH3H2O+H+水解平衡向右移动,H+浓度增大,导致阴极放出氢气
NH3H2O+H+水解平衡向右移动,H+浓度增大,导致阴极放出氢气
【解析】
依据含镍废料生产Ni2O3的工艺流程图,分析每一步加入的试剂、发生的反应、生成的产物,明确操作的作用。其中离子方程式的书写与配平、关系式的应用、图象的分析,是解决问题的关键。
(1)据化合价的代数为零,求得NiOOH中Ni的化合价为+3。
(2)酸浸时废料中的杂质铁与盐酸反应生成FeCl2,加入双氧水将Fe2+氧化,离子方程式为2Fe2++2H++H2O2=2Fe3++2H2O。溶液中Fe3+水解:Fe3++3H2O![]() Fe(OH)3+3H+,调pH时Na2CO3与H+反应使平衡右移,生成Fe(OH)3沉淀,滤渣A的主要成分是Fe(OH)3。
Fe(OH)3+3H+,调pH时Na2CO3与H+反应使平衡右移,生成Fe(OH)3沉淀,滤渣A的主要成分是Fe(OH)3。
(3)酸溶时NiCO3与盐酸反应生成NiCl2,碱性溶液中NaClO氧化NiCl2的离子方程式为2Ni2++ClO-+4OH-=Ni2O3+Cl-+2H2O,步骤①中NaOH/NaClO最佳物质的量之比4 : 1。
(4)以惰性电极电解NiCl2溶液时,阳极Cl-失电子生成Cl2(2Cl--2e-=Cl2↑),进而与碱反应生成氧化剂ClO-(Cl2+2OH-=Cl-+ClO-+H2O);阴极水得电子生成H2。故Na2SO4不参与电解反应,其作用是增大溶液中离子浓度,增强溶液导电性。
据2Ni2+~ClO-~Cl2,n mol二价镍全部转化为三价镍需要0.5n molCl2,则电解时阳极生成 Cl2 0.5n mol/40%=1.25n mol,电路中转移电子 2.5n mol。
(5)据图,镍的成粉率最高时NH4Cl溶液的浓度约10gL-1。随着NH4Cl溶液浓度增大,水解平衡NH4++H2O![]() NH3H2O+H+向右移动,H+浓度增大,在阴极得电子放出氢气。
NH3H2O+H+向右移动,H+浓度增大,在阴极得电子放出氢气。


科目:高中化学 来源: 题型:
【题目】以下物质间的每步转化通过一步反应都能实现的是( )
A.Al→Al2O3→Al(OH)3→NaAlO2B.Fe→FeCl2→FeCl3→Fe(OH)3
C.S→SO3→H2SO4→MgSO4D.Na→Na2O→Na2O2→NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于C60、H3、O2-、N5+等微粒的叙述错误的是
A. 碳、氢、氧、氮元素各含有不同核素
B. H3与H2化学性质相同,互为同位素
C. C60与N5+中都含有共价键
D. KO2属于含有共价键的离子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,b、d是运用有机合成制备的具有立体结构的有机物,p、m是广泛存在于动植物体内萜类化合物,下列说法正确的是

A. b与d互为同分异构体,p与m互为同分异构体
B. b、d、p中,只有p的所有碳原子在同一个平面上
C. d、p、m均可与酸性高锰酸钾溶液反应
D. b的二氯代物有三种,d与H2加成后的产物的一氯代物有四种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】右图表示反应N2(g)+3H2(g)![]() 2NH3(g); ΔH=-92.2kJ/mol。 在某段时间t0~ t6中反应速率与反应过程的曲线图,则氨的百分含量最高的一段时间是 ( )
2NH3(g); ΔH=-92.2kJ/mol。 在某段时间t0~ t6中反应速率与反应过程的曲线图,则氨的百分含量最高的一段时间是 ( )

A、t0—t1 B t2—t3 C t3—t4 D t5—t6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水提溴过程中,将溴吹入吸收塔,使溴蒸气和吸收剂SO2发生作用以达到富集的目的,化学反应为Br2+SO2+2H2O===2HBr+H2SO4,下列说法正确的是( )。
A. Br2在反应中表现氧化性 B. SO2在反应中被还原
C. Br2在反应中失去电子 D. 1 mol氧化剂在反应中得到1 mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋具有十分巨大的开发潜力,人们可以从海水中获得多种物质.工业上进行海水淡化有多种方法.
(1)蒸馏法是历史悠久,技术和工艺比较成熟的海水淡化方法,如图1是海水蒸馏法装置示意图,仪器B的名称是__________。

(2)图2是膜分离技术进行淡化的原理示意图,水分子可以透过淡化膜,而海水中其他各种粒子不能通过淡化膜,加压后,右侧海水中减少的是______(填字母)。
A.溶质质量 B.溶剂质量 C.溶质的物质的量浓度
Ⅱ.从海水中提取一些重要的化工产品的工艺流程如图所示。

根据上述流程图回答下列问题:
(3)标准状况下22.4 L Cl2气体发生反应②,转移的电子数是________NA。
(4)过程③到过程⑤的变化为“Br-→Br2→Br-→Br2”,其目的是_______________。
(5)过程⑥⑦⑧⑨⑩中没有涉及的化学反应类型是______。
A.分解反应 B.化合反应 C.复分解反应 D.置换反应
(6)写出反应④与⑩的化学方程式
④________________________________________________;
⑩________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素X、Y、Z、W、R、Q原子序数依次增大。由这些元素组成的化合物甲、乙、丙、丁的0.1mol/L水溶液pH如下表,丙、丁为二元化合物。甲溶液逐滴滴入丙溶液中,先产生白色沉淀,后沉淀消失;乙的水溶液可除油污。下列说法一定正确的是

A. W和Q形成的化合物只含有离子键
B. Y和Z的氢化物沸点:Y<Z
C. 离子半径:r(Q>r(R)>r(Z)
D. Y和Q氧化物的水化物酸性:Q>Y
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】意大利罗马大学的Fulvio Cacace等人获得了极具理论研究意义的气态N4分子,其分子结构如图所示。已知断裂1 mol N—N吸收167 kJ热量,生成1 mol N![]() N放出942 kJ热量,根据以上信息和数据,判断下列说法正确的是 ( )
N放出942 kJ热量,根据以上信息和数据,判断下列说法正确的是 ( )

A. N4属于一种新型的化合物B. N4分子中存在极性键
C. N4分子中N—N键角为109°28′D. 1 mol N4转变成N2将放出882 kJ热量
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com