
设 NA为阿伏加德罗常数的数值,下列说法错误的是( )
A.已知 N2 (g)+3H2 (g) 2NH3(g) △H =-92.4 kJ·mol-1,当有 1molNH3时,上述反应的 △H 变为-46.2 kJ·mol-1
2NH3(g) △H =-92.4 kJ·mol-1,当有 1molNH3时,上述反应的 △H 变为-46.2 kJ·mol-1
B.1mol 羟基(—OH)与 17gNH3所含电子数都为NA
C.由 8.0gCH3COONa 和少量 CH3COOH 形成的中性溶液中,CH3COO-数目为0.1NA
D.常温常压下,7.1gCl2与足量的Fe粉反应转移的电子数为0.2NA
 每课必练系列答案
每课必练系列答案 巧学巧练系列答案
巧学巧练系列答案科目:高中化学 来源:2016届重庆市高三三诊理综化学试卷(解析版) 题型:简答题
甲醇是一种可再生能源,具有广泛的开发和应用前景。工业上一般采用下列反应合成甲醇C O(g)+2H2 (g)
O(g)+2H2 (g) CH3OH(g) ΔH
CH3OH(g) ΔH
(1)下表所列数据是反应在不同温度下的化学平衡常数(K)。

由表中数据判断ΔH________0 (填“>”、“=”或“<”),化学平衡常数表达式K=________;
(2)300℃时,在体积为2.0 L的密闭容器中通入2 mol CO和4 mol H2,经过20 s达到平衡状态,
①计算20 s内CO的反应速率为________,此时容器中甲醇的体积分数为_________;
②若向 上述平衡体系中同时加入1mol CO,2mol H2和1m
上述平衡体系中同时加入1mol CO,2mol H2和1m ol CH3OH气体,平衡移动情况是__________(填“向右”、“向左”或“不移动”),原因是________________________
ol CH3OH气体,平衡移动情况是__________(填“向右”、“向左”或“不移动”),原因是________________________
(3)已知在常温常压下:
①2CH3OH(l)+3O2 (g) = 2CO2 (g)+4H2O(g) ΔH=-1277.0kJ/mol
②2CO(g)+O2 (g) = 2CO2(g) ΔH=-566.0kJ/mol
③H2O(g) =H2O(l) ΔH=-44kJ/mol写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:
__________________;
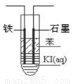
(4)甲醇、氧气可制作燃料电池,写出以氢氧化钾为电解质甲醇燃料电池负极反应式_______________;如图,电解KI溶液制碘,在粗试管中加入饱和的KI溶液,然后再加入苯,插入一根石墨电极和一根铁电极,使用该燃料电池做电源,铁电极与极___________(填正或负)相连接,通电一段时间后,断开电源,振荡试管,上层溶液为_______色, 当有 1.27g碘单质生成时,需要_______g C
当有 1.27g碘单质生成时,需要_______g C H3OH。
H3OH。
查看答案和解析>>
科目:高中化学 来源:2016届江苏省高三考前热身(五模)化学试卷(解析版) 题型:选择题
煤气化的一种方法是在气化炉中给煤炭加氢,发生的主要反应为:C(s)+2H2(g)?CH4(g).在VL的容器中投入a mol碳(足量),同时通入2a molH2,控制条件使其发生上述反应,实验测得碳的平衡转化率随压力及温度的变化关系如图所示.下列说法正确的是( )

A.上述正反应为吸热反应
B.在5MPa、800K时,该反应的平衡常数为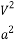 L2•mol-2
L2•mol-2
C.在4MPa、1200K时,图中X点υ(H2)正>υ(H2)逆
D.工业上维持6MPa 1000K而不采用10MPa1000K,主要是因为前者碳的转化率高
查看答案和解析>>
科目:高中化学 来源:2016届海南师大附中高三临考模拟化学试卷(解析版) 题型:填空题
太阳能电池板材料除单晶硅外,还有铜、铟、镓、硒等化学物质。
(1)基态硅原子的电子排布式:_______________。
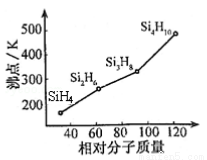
(2)有一类组成最简单的有机硅化合物叫硅烷。硅烷的组成、结构与相应的烷烃相似。硅烷中硅采取____杂化方式,硅烷的沸点与相对分子质量的关系如图所示,呈现这种变化的原因是_______________。
(3)硒和硫同为VIA族元素,与其相邻的元素有砷和溴,则三种元素的电负性由小到大的顺序为_______。 (用元素符号表示)
(4)气态SeO3分子的立体构型为_________,与SeO3互为等电子体的一种离子为____________(填化学式)。
(5)一种铜金合金晶体具有面心立方最密堆积结构,在晶胞中金原子位于顶点,铜原子位于面心,则该合金中金原子(Au)与铜原子(Cu)个数比为_________;若该晶体的晶胞棱长为a pm,则该合金密度为______g/cm 3。(列出计算式,不要求计算结果,阿伏伽德罗常数的值为NA)
查看答案和解析>>
科目:高中化学 来源:2016届海南师大附中高三临考模拟化学试卷(解析版) 题型:推断题
以乙烯为原料合成环状化合物 E(C4H4O4)的流程如下。

请回答下列问题:
(1)E 的结构简式是_______________;C 中所含官能团的名称是____________。
(2)在乙烯的同系物中,所有碳原子一定共平面且碳原子数最多的分子的结构简式是__________,名称(系统命名)是______________。
(3)反应①〜⑤中,属于取代反应的是_______(填写编号)。
(4)写出反应②的化学方程式______________ 。
(5)F是E的同分异构体,且1 mol F与足量的 NaHCO3溶液反应可放出2mol CO2气体,请写出符合条件的F的所有的结构简式______________ 。
(6)参照上述合成路线的表示,设计以乙烯为原料制备乙二醇的最简合成路线:
__________________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源:2016届海南师大附中高三临考模拟化学试卷(解析版) 题型:选择题
下列描述中,正确的是( )
A.由 CH3CH2OH(l)+3O2(g) =2CO2 (g)+3H2O(g) ΔH=-1366.8 kJ·mol-1 ,可知乙醇的标准燃烧热为1366.8 kJ·mol-1
B.已知:C(金刚石,s)=C(石墨,s) ΔH<0,则金刚石比石墨稳定
C.已知:N2(g)+O2(g)=2NO(g) ΔH=+180 kJ·mol-1
2CO(g)+O2(g)=2CO2 (g) Δ H=-566 kJ·mol-1则 2CO(g)+2NO(g)===N2 (g)+2CO2(g) ΔH=-746 kJ·mol-1
D.OH-(aq)+H+(aq)===H2O(l) ΔH=-57.3 kJ·mol-1 故1 molHNO3与1mol NH3•H2O 完全反应,放出的热量一定为57.3 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源:2016届安徽省高三下冲刺模拟理综化学C卷(解析版) 题型:简答题
碘及其化合物在合成杀菌剂、药物等方面具有广泛用途。回答下列问题:
(1)海带中富含碘,请简述检验碘的实验方案_____________________;
(2)已知反应2HI(g)═H2(g)+I2(g)的△H=+11kJ•mol-1,1molH2(g)、1molHI(g)分子中化学键断裂时分别需要吸收436KJ、299KJ的能量,则1molI2(g)分子中化学键断裂时需吸收的能量为_________kJ;
(3)Bodensteins研究了下列反应:2HI(g) H2(g)+I2(g)
H2(g)+I2(g)
在716K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如表:
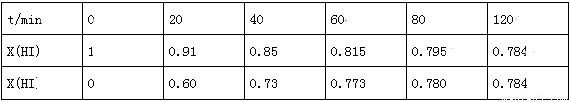
①根据上述实验结果,该反应的平衡常数K的计算式为:______________;(不用求出结果)
②其他条件不变,向平衡后体系中再加入少量HI,则平衡向_______(填“正”或“逆”)反应方向移动,达到平衡后x(HI)_______(填“增大”、“减小”或“不变”)。
③上述反应中,正反应速率为v正=k正x2(HI),逆反应速率为v逆=k逆x(H2)x(I2),其中k正、k逆为速率常数,则k逆为_______(以K和K正表示);若k正=0.0027min-1,在t=40min时,v正=________min-1.
④由上述实验数据计算得到v正~x(HI)和v逆~x(H2)的关系可用如图表示.当升高到某一温度时,反应重新达到平衡,相应的点分别为__________(填字母)。
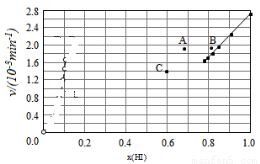
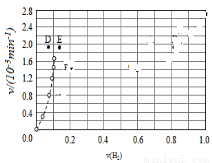
查看答案和解析>>
科目:高中化学 来源:2015-2016学年黑龙江牡丹江一中高二6月月考化学试卷(解析版) 题型:选择题
常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A.强酸性溶液:Mg2+、K+、SO42-、NO3-
B.使酚酞变红色的溶液:Na+、Cu2+、HCO3-、NO3-
C.0.1 mol·L–1 AgNO3溶液:H+、K+、SO42-、I-
D.0.1 mol·L–l NaAlO2溶液:H+、Na+、Cl-、SO42-
查看答案和解析>>
科目:高中化学 来源:2015-2016学年辽宁沈阳二中高二6月小班成果验收化学卷(解析版) 题型:选择题
有机物X和Y可作为“分子伞”给药载体的伞面和中心支撑架(未表示出原子或原子团的空间排列)。
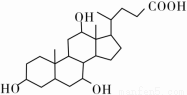
X(C24H40O5)
H2NCH2CH2CH2NHCH2CH2CH2CH2NH2 Y
下列叙述错误的是 ( )。
A.1 mol X在浓硫酸作用下发生消去反应,最多生成3 mol H2O
B.1 mol Y发生类似酯化的反应,最多消耗2 mol X
C.X与足量HBr反应,所得有机物的分子式为C24H37O2Br3
D.Y和癸烷的分子链均呈锯齿形,但Y的极性较强
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com