
【题目】微生物燃料电池(MPC)处理技术是通过微生物的作用去除污染物,该技术可广泛应用于去除土壤中有机污染物。一种土壤微生物燃料电池的纵截面如图所示,下列说法不正确的是
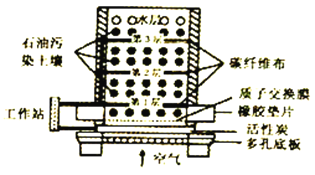
A. 电流从活性炭电极经工作站流向碳纤维布电极
B. 有机污染物在电池负极上氧化为对环境无害的物质
C. 活性炭能有效吸附空气,提高电池的工作效率
D. 该电池的正极反应式为O2+4e-↓+2H2O==4OH-
 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案 名校提分一卷通系列答案
名校提分一卷通系列答案科目:高中化学 来源: 题型:
【题目】Ⅰ.镓(Ga)位于周期表的第四周期,与Al同主族,主要存在Ga3+、GaO2-两种离子形式,被广泛应用于电子工业。
(1)用铝粉和Fe2O3做铝热反应实验,需要的试剂还有__________________。
a.KClO3 b. KCl c. MnO2 d. Mg
(2)半导体材料氮化镓由Ga与NH3在一定条件下发生置换反应生成。该过程每生成1molGaN(s)放出热量15.4kJ。镓在周期表中的序号_____________,写出该反应的热化学方程式_________________。
(3)工业上用电解法精炼镓。具体原理如图所示,已知:金属的活动性Zn>Ga>Fe>Cu

①电解精炼镓一段时间后形成的阳极泥主要有______________
②已知精炼时阴极反应:GaO2-+3e-+2H2O=Ga+4OH- 。阳极的电极反应方程式:___________________________________;
Ⅱ.用废铁皮制取铁红(Fe2O3)的部分流程示意图如下:

(4)步骤I温度不能过高。因为:_______________________________。
(5)步骤II中发生反应4Fe(NO3)2+O2+(2n+4)H2O=2Fe2O3·nH2O+8HNO3,生成的硝酸又将废铁皮中的铁转化为Fe(NO3)2。
写出后者反应的离子方程式______________________________________。
(6)上述生产流程中,能体现“绿色化学”思想的是______________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂-空气电池是一种新型的二次电池,由于具有较高的比能量而成为未来电动汽车的希望。其放电时的工作原理如图所示。下列说法正确的是
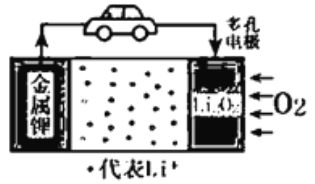
A. 该电池放电时,锂电极发生了还原反应
B. 放电时,Li+向锂电极迁移
C. 电池中的电解液可以是有机电解液或稀盐酸等
D. 充电时,电池正极的反应式为Li2O2-2e-=2Li++O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据有关知识回答下列问题
(1)25℃时,0.1 molL-1的一元酸HA溶液中c(H+)=1.0×10-4 molL-1,请回答下列问题:此时溶液的pH=_______,HA是________酸(填“强”或“弱”)。
(2)现有NaHCO3、NaHSO3、NaHSO4三种常见的酸式盐,它们在工业生产和日常生活中有着广泛的应用。请回答有关问题:
①25℃时,NaHCO3的水溶液显_____性(填“酸”或“碱”)。
②25℃时,物质的量浓度均为0.01 molL-1的三种酸式盐溶液,pH最小是_________。
(3)向50ml 0.018molL-1的AgNO3溶液中加入50m1 0.020molL-1的盐酸生成AgCl沉淀。已知该温度下Ksp(AgCl)=1.0×10﹣10,忽略溶液的体积变化,完全沉淀后,溶液中c(Ag+)=__molL-1。
(4)用酸性KMnO4溶液滴定含杂质的Na2C2O4样品(杂质不参与反应)。
实验步骤:准确称取1g Na2C2O4固体样品,配制成100mL溶液,取出20.00mL于锥形瓶中。再向锥形瓶中加入足量稀H2SO4溶液,用0.016 molL-1高锰酸钾溶液滴定,滴定至终点时消耗高锰酸钾溶液25.00mL。
(已知:5H2C2O4+2KMnO4+3H2SO4=10CO2↑+2MnSO4+K2SO4+8H2O)
①高锰酸钾溶液应装在_______滴定管中.(填“酸式”或“碱式”)。
②滴定至终点时的实验现象是:__________________________________________。
③下列操作可能使测量结果偏高的是__________。
A.盛装的Na2C2O4的滴定管没润洗
B.盛装高锰酸钾溶液的滴定管滴定前尖嘴处有气泡,滴定后气泡消失
C.读数时滴定前仰视,滴定后俯视
D.锥形瓶中残留少量水
④计算样品中Na2C2O4的纯度______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物F是一种临床常用的基本药物,有广泛的用途,其合成路线如下:
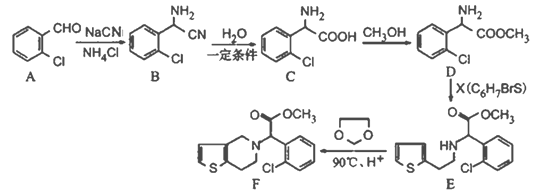
(1)写出B的分子式________________;C中碱性官能团的名称为____________________。
(2)写出与A含有相同官能团,属于芳香族化合物;且含有3种不同化学环境氢原子的同分异构体的结构简式__________________________________。
(3)C→D的反应类型是______________;X的结构简式为______________________。
(4)两个C分子可在一定条件下反应生成一种产物,该产物分子中含有3个六元环,写出该反应的化学方程式____________________________________。
(5)已知: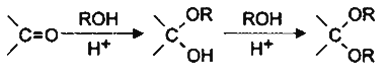
I.则由乙醇、甲醇为有机原料制备化合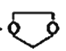 物,不需要经历下列的反应类型有____(填写编号)。
物,不需要经历下列的反应类型有____(填写编号)。
①加成反应,②消去反应,③取代反应,④氧化反应,⑤还原反应。
II.写出制备化合物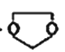 的最后一步反应的化学方程式________________________。
的最后一步反应的化学方程式________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA表示阿伏加德罗常数的值,下列叙述正确的是( )
A. 等物质的量的N2和CO所含分子数均为NA
B. 常温下,0.1molCuSO4·5H2O晶体中氧原子数目为0.4 NA
C. NA个N2分子所占的体积与0.5NA个H2分子所占的体积比为2∶1
D. 常温下,1L 0.1mol·L-1的NH4NO3溶液中氮原子数为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,有c(CH3COOH)+c(CH3COO-)=0.1mol·L-1的一组醋酸、醋酸钠混合溶液,溶液中c(CH3COOH)、c(CH3COO-)二者所占物质的量分数(a)随溶液pH变化的关系如图所示。下列说法错误的是
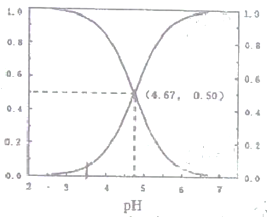
A. pH<4.67的溶液中:c(CH3COO-)<c(CH3COOH)
B. pH=7的溶液中:c(CH3COOH)=0,c(CH3COO-)=1.0
C. 在pH=4.67的溶液中:c(Na+)+c(H+)=c(CH3COOH)+c(0H-)
D. pH=3.5的溶液中:c(Na+)+c(H+)-c(OH-)+c(CH3COOH)=0.1mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车剧烈碰撞时,安全气囊中发生反应10NaN3+2KNO3= K2O+5Na2O+16N2↑,对于该反应,下列判断正确的是
A. NaN3中氮元素的化合价为-3
B. 氧化剂和还原剂是同一物质
C. 被氧化的氮原子与生成的氮气分子个数之比为15:8
D. 反应过程中若转移1mol电子,则产生2.24L气体(标准状况)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com