
| A. | 食盐、淡水 | B. | 氯、溴、碘 | C. | 钠、镁、铝 | D. | 烧碱、氢气 |
分析 根据从海水制备物质的原理可知,金属单质与非金属单质需要利于化学反应来制取,而食盐可利用蒸发原理,淡水利于蒸馏原理来得到.
解答 解:A.把海水用蒸馏等方法可以得到淡水,把海水经太阳暴晒,蒸发水分后即得食盐,不需要化学变化就能够从海水中获得,故A正确;
B.可从海水中获得氯化钠,通过电解熔融氯化钠得到钠和氯气,是化学变化,通过氯气将溴离子和碘离子氧化为溴单质和碘单质,是化学变化,故B错误;
C.可从海水中获得氯化钠,电解熔融氯化钠得到钠和氯气,是化学变化,通过电解熔融的氯化镁和氧化铝即得镁和铝,是化学变化,故C错误;
D.可从海水中获得氯化钠,配制成饱和食盐水,然后电解得烧碱、氢气和氯气,是化学变化,故D错误;
故选A.
点评 本题考查了海水的成分,海水提炼氯气、溴、碘、钠、镁、氢气等物质的原理,题目难度不大,掌握原理是解题的关键.


科目:高中化学 来源: 题型:推断题
 .
.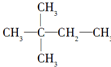 ,则A的结构简式为(CH3)3CCH=CH2.
,则A的结构简式为(CH3)3CCH=CH2.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稀醋酸中加入少量醋酸钠固体减小醋酸的电离程度 | |
| B. | 0.02 mol•L-1HCl溶液与0.02 mol•L-1Ba(OH)2溶液等体积混合后,溶液pH约为12 | |
| C. | 两种醋酸溶液的物质的量浓度分别为c1和c2,pH分别为a和a+1,则c1=10c2 | |
| D. | pH=11的NaOH溶液与pH=3的醋酸溶液等体积混合,滴入石蕊溶液呈红色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
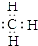 ;②Cl-的结构示意图:
;②Cl-的结构示意图: ;③乙烯的分子式:CH2=CH2④中子数为20的氳原子:${\;}_{17}^{37}$Cl;⑤乙酸分子的比例模型:
;③乙烯的分子式:CH2=CH2④中子数为20的氳原子:${\;}_{17}^{37}$Cl;⑤乙酸分子的比例模型: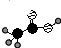 ;⑥氯乙烷的结构式:
;⑥氯乙烷的结构式: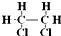
| A. | ④ | B. | ③④⑤ | C. | ④⑤⑥ | D. | ①③④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 化学键 | C-C | C-H | C-O | Si-Si | Si-H | Si-O |
| 键能/(kJ•mol-1 | 356 | 413 | 336 | 226 | 318 | 452 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硝酸可以使蛋白质变黄,称为颜色反应,该过程为物理变化 | |
| B. | 某气体能使湿润的红色石蕊试纸变蓝,该气体的水溶液一定显碱性 | |
| C. | 酯化反应是可逆反应,为了提高反应速率,一般加入浓硫酸做催化剂 | |
| D. | 油脂在碱性条件下的水解反应称为皂化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=5的H2S溶液中,c(H+)=c(HS-)=1×10-5mol•L-1 | |
| B. | pH=a的氨水溶液,稀释10倍后,其pH=b,则a=b+1 | |
| C. | pH=2的CH3COOH溶液与pH=12的NaOH溶液等体积混合,混合液的pH>7 | |
| D. | a1mLb1mol•L-1盐酸和a2mLb2mol•L-1氨水混合至中性,b1=b2,则a1<a2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ETFE分子中可能存在“-CH2-CH2-CF2-CF2-”的连接方式 | |
| B. | 合成ETFE及合成聚全氟乙丙烯的反应均为加聚反应 | |
| C. | 聚全氟乙丙烯分子的结构简式可能为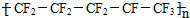 | |
| D. | 四氟乙烯中所有原子均在同一平面内 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com