
| A. | 在0.1mol•L-1 Ca(ClO)2溶液中K+、Na+、I-、Cl-可以大量共存 | |
| B. | 氢氧化铁溶于氢碘酸中的离子方程式为:Fe(OH)3+3H+═Fe3++3H2O | |
| C. | 等体积和等物质的量浓度的CH3COONH4和NH3•H2O混合液中c(CH3COOH)+c(CH3COO-)═c(NH4+)+c(NH3•H2O) | |
| D. | 常温下,浓度均为0.1mol•L-1的CH3COOH、CH3COONa混合溶液显酸性,则:c(CH3COO-)>c(Na+)>c(CH3COOH)>c(H+)>c(OH-) |
分析 A.次氯酸根离子具有强氧化性,能氧化还原性离子;
B.铁离子能氧化碘离子;
C.等体积和等物质的量浓度的CH3COONH4和NH3•H2O混合,溶液中存在物料守恒,根据物料守恒判断;
D.常温下,浓度均为0.1mol•L-1的CH3COOH、CH3COONa混合溶液显酸性,说明CH3COOH电离程度大于CH3COONa水解程度,但醋酸电离程度较小.
解答 解:A.次氯酸根离子具有强氧化性,能氧化还原性离子碘离子,所以这几种微粒不能大量共存,故A错误;
B.铁离子能氧化碘离子,离子方程式为2Fe(OH)3+2I-+6H+═2Fe2++I2+6H2O,故B错误;
C.等体积和等物质的量浓度的CH3COONH4和NH3•H2O混合,溶液中存在物料守恒,根据物料守恒得2[c(CH3COOH)+c(CH3COO-)]═c(NH4+)+c(NH3•H2O),故C错误;
D.常温下,浓度均为0.1mol•L-1的CH3COOH、CH3COONa混合溶液显酸性,则c(H+)>c(OH-),说明CH3COOH电离程度大于CH3COONa水解程度,但醋酸电离程度较小,所以微粒浓度大小顺序是c(CH3COO-)>c(Na+)>c(CH3COOH)>c(H+)>c(OH-),故D正确;
故选D.
点评 本题考查离子浓度大小比较、离子共存等知识点,为高频考点,明确离子共存条件、混合溶液中溶质成分及其性质是解本题关键,注意B中不仅发生中和反应还发生氧化还原反应,往往因为漏掉氧化还原反应而导致错误.


 捷径训练检测卷系列答案
捷径训练检测卷系列答案 小夫子全能检测系列答案
小夫子全能检测系列答案科目:高中化学 来源: 题型:解答题
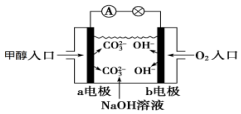 如图是甲醇燃料电池原理示意图,请回答下列问题:
如图是甲醇燃料电池原理示意图,请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 各物质的量浓度之比为c(A):c(B):c(C)=2:3:3 | |
| B. | 正逆反应速率相等且等于零 | |
| C. | 平衡混合物中各物质的量浓度相等 | |
| D. | 单位时间内,若消耗了amolA物质,则同时也消耗了1.5amolC物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
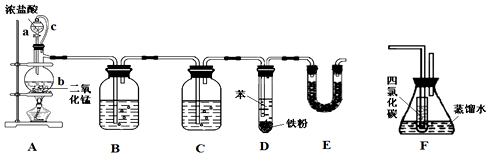
| 密度/g•cm-3 | 沸点/℃ | 水中溶解性 | |
| 苯 | 0.879 | 80.1 | 微溶 |
| 氯苯 | 1.11 | 131.7 | 不溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaOH溶液的导电能力一定比氨水强 | |
| B. | 中和等体积、等物质的量浓度的盐酸和醋酸,需要等量的NaOH | |
| C. | 若盐酸的浓度是醋酸浓度的两倍,则盐酸的c(H+)也是醋酸c(H+)的两倍 | |
| D. | 将NaOH溶液和氨水各稀释一倍,两者的c(OH-)均减小到原来的一半 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
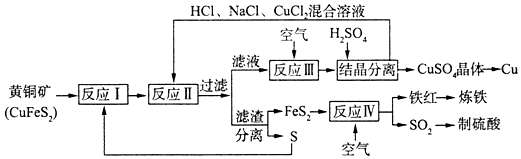
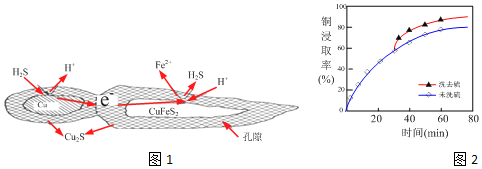
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 高炉炼铁时,增加炉高,可以改变尾气中一氧化碳的含量 | |
| B. | 厨房中燃气泄漏,立即打开抽油烟机排气 | |
| C. | “地沟油”禁止食用,但处理后可用来制肥皂和生物柴油 | |
| D. | 食盐中加碘单质可以减少碘缺乏症 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com