
| A. | 0.1 mol•L-1的Na2S溶液:c(OH-)=c(H+)+c(HS-)+c(H2S) | |
| B. | pH=11的氨水与pH=3的硫酸各1L混合后,c(NH4+)>2c(SO42-) | |
| C. | pH=11的氨水与pH=11的醋酸钠溶液,由水电离出的c(H+)相等 | |
| D. | pH相同的①NaHCO3溶液②CH3COONa溶液中的c(Na+):①>② |
分析 A.由电荷守恒可知c(Na+)+c(H+)=c(OH-)+2c(S2-)+c(HS-),由物料守恒可知c(Na+)=2[c(S2-)+c(HS-)+c(H2S)];
B.pH=11的氨水与pH=3的硫酸等体积混合,氨水过量,溶液显碱性,电荷守恒为c(NH4+)+c(H+)=c(OH-)+2c(SO42-);
C.氨水抑制水的电离,醋酸钠促进水解的电离;
D.醋酸的酸性大于碳酸,则碳酸氢钠的水解程度大,等pH时碳酸氢钠溶液的浓度小.
解答 解:A.由电荷守恒可知c(Na+)+c(H+)=c(OH-)+2c(S2-)+c(HS-),由物料守恒可知c(Na+)=2[c(S2-)+c(HS-)+c(H2S)],联立两式可知,c(OH-)=c(H+)+c(HS-)+c(H2S),故A正确;
B.pH=11的氨水与pH=3的硫酸等体积混合,氨水过量,溶液显碱性,c(H+)<c(OH-),由电荷守恒为c(NH4+)+c(H+)=c(OH-)+2c(SO42-),可知c(NH4+)>2c(SO42-),故B正确;
C.氨水抑制水的电离,醋酸钠促进水解的电离,则对水的电离影响不同,故C错误;
D.醋酸的酸性大于碳酸,则碳酸氢钠的水解程度大,等pH时碳酸氢钠溶液的浓度小,则pH相同的①NaHCO3溶液②CH3COONa溶液中的c(Na+):①<②,故D错误;
故选AB.
点评 本题考查离子浓度大小的比较,为高频考点,把握水解与电离、物料守恒、电荷守恒为解答的关键,侧重分析与应用能力的考查,注意选项B为解答的难点,题目难度不大.


 教学练新同步练习系列答案
教学练新同步练习系列答案科目:高中化学 来源: 题型:选择题
| A. | 1mol•L-1 NaClO4溶液中所含ClO4-数目为NA | |
| B. | 标准状况下,11.2L CCl4所含极性键的数目为2NA | |
| C. | 过氧化钠与水反应时,生成0.1mol氧气转移的电子数为0.2NA | |
| D. | 在0.1molNaHSO4晶体中,阳离子与阴离子总数为0.3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| 物质 | 沸点/℃ | 熔点/℃ | 溶解性 |
| 甲醇 | 64.7 | -97.8 | 易溶于水 |
| 3,5-二甲氧基苯酚 | 172~175 | 33~36 | 易溶于甲醇、乙醚,微溶于水 |
| A. | 分离出甲醇的操作是结晶 | |
| B. | 间苯三酚与苯酚互为同系物 | |
| C. | 上述合成反应属于取代反应 | |
| D. | 洗涤时可以用饱和Na2CO3溶液除氯化氢 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | a=+90.3 | |
| B. | 恒温恒压下,在已达平衡的反应I体系中再充入少量He时平衡正向移动 | |
| C. | 其他条件不变,加压对反应Ⅱ的反应速率无影响 | |
| D. | 其他条件不变,升高温度可提高反应Ⅲ中CO2的转化率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 上述转化属于分解反应 | B. | 上述反应过程放出大量热 | ||
| C. | 生成的CaO可作氯气的干燥剂 | D. | CaCO3水泥的主要成分之一. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,Cu-Zn原电池中,正极产生1.12LH2时,转移的电子数应小于0.1NA | |
| B. | 1molSO2与足量O2在一定条件下反应生成SO2,共转移2NA个电子 | |
| C. | 2.1gDTO中所含中子数为NA | |
| D. | 常温常压下,28gC2H4、CO的混合气体中含有碳原子的数目为1.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
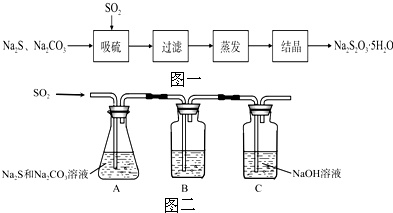
| 序号 | 实验操作 | 预期现象 | 结论 |
| ① | 取少量样品于试管中,加入适量蒸馏水,充分振荡溶解,滴加足量稀硝酸,再滴加少量AgNO3溶液,振荡. | 有白色沉淀生成 | 样品含NaCl |
| ② | 另取少量样品于烧杯中,加入适量蒸馏水,充分搅拌溶解,加入过量CaCl2溶液,搅拌,静置,用pH计测定上层清液pH. | 有白色沉淀生成,上 层清液pH>10.2 | 样品含NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
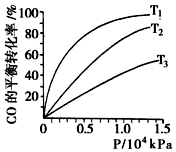 汽车尾气作为空气污染的主要来源之一,含有大量的有害物质,包括CO、
汽车尾气作为空气污染的主要来源之一,含有大量的有害物质,包括CO、| 容器编号 | 温度(℃) | 起始物质的量(mol) | 平衡物质的量(mol) | |
| CH3OH(g) | CH3OCH3(g) | H2O | ||
| Ⅰ | 387 | 0.20 | 0.080 | 0.080 |
| Ⅱ | 207 | 0.20 | 0.090 | 0.090 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com