
分析 (1)酸溶液、强酸弱碱盐溶液和强酸酸式盐溶液均显酸性;
(2)NaHCO3溶液中HCO3-存在电离平衡和水解平衡;
(3)盐酸为一元强酸,硫酸为二元弱酸,醋酸为一元弱酸;盐酸、硫酸为强酸,醋酸是弱酸,在加水稀释后,醋酸的电离平衡被促进;
(4)氯化银的溶解平衡的表达式AgCl(S)?Ag+(aq)+Cl-(aq).
解答 解:(1)a.NH3•H2O是一元弱碱,在溶液中显碱性,故a错误;
b.CH3COONa是强碱弱酸盐,水解显碱性,故b错误;
c.NH4Cl是强酸弱碱盐,水解显酸性,故c正确;
d.NaHSO4在溶液中电离为钠离子、氢离子和硫酸根离子,溶液显酸性,故d正确.
故选cd.
(2)NaHCO3溶液中HCO3-存在电离平衡和水解平衡,方程式分别为:HCO3-?H++CO32-、HCO3-+H2O?H2CO3+OH-,故答案为:HCO3-?H++CO32-、HCO3-+H2O?H2CO3+OH-;
(3)硫酸为二元强酸,盐酸为以元强酸,醋酸为一远弱酸,等浓度时硫酸中氢离子浓度最大,醋酸中氢离子浓度最小,故三种溶液的c(H+)大小顺序为②>①>③;
盐酸、硫酸为强酸,不存在电离平衡,而醋酸是弱酸,在加水稀释后,醋酸的电离平衡被促进,故若三种溶液的pH都为2,分别取10mL上述溶液加水稀释至1000mL,则稀释后盐酸和硫酸溶液中的氢离子浓度直线下降,均变为4,而醋酸溶液中的氢离子浓度下降程度较小,即稀释后溶液pH小于4,故三溶液中的pH大小为①=②>③,故答案为:②>①>③;①=②>③;
(4)氯化银的溶解平衡的表达式AgCl(S)?Ag+(aq)+Cl-(aq),故答案为:AgCl(S)?Ag+(aq)+Cl-(aq);
点评 本题考查了弱电解质的电离、难溶物的溶解平衡、盐类水解等知识点,这些知识点常常综合考查,明确弱电解质的电离程度与弱离子水解程度的关系是解本题关键,再结合溶度积常数分析解答,注意中和一定物质的量的强碱时,需要相同浓度酸的体积与酸的元数有关,与电解质强弱无关,为易错点.


科目:高中化学 来源: 题型:选择题
| A. | 1:1 | B. | 1:3 | C. | 1:2 | D. | 3:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
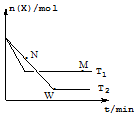 一定温度下,向某密闭容器中通入X,发生反应:4X(g)?2Y(g)+Z(g)△H,在温度分别为T1、T2 的条件下X的物质的量n(X) 随时间t的变化曲线如图所示.下列有关叙述错误的是( )
一定温度下,向某密闭容器中通入X,发生反应:4X(g)?2Y(g)+Z(g)△H,在温度分别为T1、T2 的条件下X的物质的量n(X) 随时间t的变化曲线如图所示.下列有关叙述错误的是( )| A. | △H<0 | |
| B. | 平衡时Z的产率:T2<T1 | |
| C. | M、N、W三点对应的混合气体的平均相对分子质量:W>M>N | |
| D. | M点的正反应速率大于N点的逆反应速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2 min内,用A表示的反应速率是0.4 mol•L-1•min-1 | |
| B. | 分别用B、C、D表示的反应速率其比值是1:1:1 | |
| C. | 2 min时间内反应速率,用B表示是0.3 mol•L-1•min-1 | |
| D. | 2 min内用C表示的反应速率v (C)是0.3 mol•L-1•min-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验序号 | 操作及现象 |
| i | 取少量固体样品,加入过量稀盐酸,固体溶解,产生无色气体(经检验为H2),溶液呈浅黄色 |
| ii | 向i所得溶液中加入少量KSCN溶液,溶液呈浅红色,再加入H2O2溶液,产生无色气体(经检验为O2),溶液变为深红色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
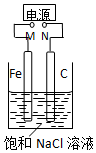
| A. | M接电源正极,N接电源负极,将C电极换成Cu电极,电解质溶液换成CuSO4溶液,则可实现在铁上镀铜 | |
| B. | M接负极,N接正极,在溶液中滴人酚酞试液,C电极周围溶液变红 | |
| C. | M接负极,N接正极,若把烧杯中溶液换成1 L CuSO4溶液,反应一段时间后,烧杯中产生蓝色沉淀 | |
| D. | M接负极,N接正极,当两极产生气体总量为22.4 L(标准状况)时,生成1molNaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 丙烯分子有7个σ键和1个π键 | |
| B. | 丙烯分子中有3个碳原子在同一直线上 | |
| C. | 丙烯分子中3个碳原子都是sp3杂化面上 | |
| D. | 丙烯分子存在非极性键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③④⑤⑥⑧ | B. | ③⑤⑧ | C. | ②④ | D. | ②④⑤ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com