
【题目】信息时代产生的大量电子垃圾对环境造成了极大的威胁.某“变废为宝”学生探究小组将一批废弃的线路板简单处理后,得到含![]() 、
、![]() 、
、![]() 及少量Au、Pt等金属的混合物,并设计出如下制备硫酸铜晶体的路线:
及少量Au、Pt等金属的混合物,并设计出如下制备硫酸铜晶体的路线:

回答下列问题:
![]() 第
第![]() 步Cu与酸反应的离子方程式为 ______ ;得到滤渣1的主要成分为 ______ .
步Cu与酸反应的离子方程式为 ______ ;得到滤渣1的主要成分为 ______ .
![]() 第
第![]() 步加入
步加入![]() 的作用是 ______ ,使用
的作用是 ______ ,使用![]() 的优点是 ______ ;调节pH的目的是使 ______ 生成沉淀.
的优点是 ______ ;调节pH的目的是使 ______ 生成沉淀.
![]() 由滤渣2制取
由滤渣2制取![]() ,探究小组设计了三种方案:
,探究小组设计了三种方案:

上述三种方案中, ______ 方案不可行,原因是 ______ ;
![]() 探究小组用滴定法测定
探究小组用滴定法测定![]() 含量.取ag试样配成100mL溶液,每次取
含量.取ag试样配成100mL溶液,每次取![]() ,消除干扰离子后,用c
,消除干扰离子后,用c![]()
![]() 标准溶液滴定至终点,平均消耗EDTA溶液b
标准溶液滴定至终点,平均消耗EDTA溶液b![]() 滴定反应如下:
滴定反应如下:![]() 写出计算
写出计算![]() 质量分数的表达式
质量分数的表达式![]() ______ .
______ .
【答案】 Au、Pt 把
Au、Pt 把![]() 氧化为
氧化为![]() 不引入杂质,产物对环境无污染
不引入杂质,产物对环境无污染 ![]() 、
、![]() 甲 滤渣中只加硫酸会生成硫酸铁和硫酸铝,冷却、结晶、过滤得到的硫酸铝晶体中混有大量硫酸铁杂质
甲 滤渣中只加硫酸会生成硫酸铁和硫酸铝,冷却、结晶、过滤得到的硫酸铝晶体中混有大量硫酸铁杂质 ![]()
【解析】
金属的混合物与稀硫酸、浓硝酸混合后加热,Cu、Al、Fe发生反应生成Cu2+、Al3+、Fe2+,而Au、Pt不反应,所以滤渣1 的成分是Pt和Au,滤液1中的离子是Cu2+、Al3+、Fe2+、Fe3+,第②步加H2O2的作用是把Fe2+氧化为Fe3+,该氧化剂的优点是不引入杂质,产物对环境物污染,调溶液PH的目的是使Fe3+和Al3+形成沉淀.所以滤液2的成分是Cu2+,经蒸发结晶可得到CuSO45H2O晶体,滤渣2的成分为氢氧化铁和氢氧化铝,在滤渣中加NaOH,和Al(OH)3反应生成NaAlO2,再在滤液中加H2SO4生成Al2(SO4)3,蒸发、冷却、结晶、过滤可得硫酸铝晶体。
![]() 稀硫酸、浓硝酸混合酸后加热,Cu、Al、Fe发生反应生成
稀硫酸、浓硝酸混合酸后加热,Cu、Al、Fe发生反应生成![]() 、
、![]() 、
、![]() ;所以滤渣1的成分是Pt和Au,滤液1中的离子是
;所以滤渣1的成分是Pt和Au,滤液1中的离子是![]() 、
、![]() 、
、![]() ;第
;第![]() 步Cu与酸反应的离子方程式为:
步Cu与酸反应的离子方程式为: ,Au、Pt和酸不反应,所以是滤渣;
,Au、Pt和酸不反应,所以是滤渣;
故答案为: ,Au、Pt;
,Au、Pt;
![]() 第
第![]() 步加
步加![]() 的作用是将
的作用是将![]() 氧化为
氧化为![]() ,过氧化氢做氧化剂不引入杂质,对环境无污染,调节溶液PH铁离子和铝离子全部沉淀后过滤得到氢氧化铁、氢氧化铝沉淀和滤液硫酸铜,故答案为:将
,过氧化氢做氧化剂不引入杂质,对环境无污染,调节溶液PH铁离子和铝离子全部沉淀后过滤得到氢氧化铁、氢氧化铝沉淀和滤液硫酸铜,故答案为:将![]() 氧化为
氧化为![]() ,不引入杂质,产物对环境无污染,
,不引入杂质,产物对环境无污染,![]() 、
、![]() 生成沉淀;
生成沉淀;
![]() 制备硫酸铝晶体的甲、乙、丙三种方法中,甲方案在滤渣中只加硫酸会生成硫酸铁和硫酸铝,冷却、结晶、过滤得到的硫酸铝晶体中混有大量硫酸铁杂质,方法不可行,故答案为:甲,滤渣中只加硫酸会生成硫酸铁和硫酸铝,冷却、结晶、过滤得到的硫酸铝晶体中混有大量硫酸铁杂质;
制备硫酸铝晶体的甲、乙、丙三种方法中,甲方案在滤渣中只加硫酸会生成硫酸铁和硫酸铝,冷却、结晶、过滤得到的硫酸铝晶体中混有大量硫酸铁杂质,方法不可行,故答案为:甲,滤渣中只加硫酸会生成硫酸铁和硫酸铝,冷却、结晶、过滤得到的硫酸铝晶体中混有大量硫酸铁杂质;
![]() 取
取![]() 试样配成100mL溶液,每次取
试样配成100mL溶液,每次取![]() ,消除干扰离子后,用
,消除干扰离子后,用![]() 标准溶液滴定至终点,平均消耗EDTA溶液
标准溶液滴定至终点,平均消耗EDTA溶液![]() 滴定反应如下:
滴定反应如下:![]() 铜离子物质的量和标准液物质的量相同
铜离子物质的量和标准液物质的量相同![]() ;依据元素守恒得到:
;依据元素守恒得到:
则20ml溶液中含有的![]() 物质的量为
物质的量为![]() ;100ml溶液中含
;100ml溶液中含![]() ;
;
所以![]() 质量分数的表达式
质量分数的表达式![]() ;故答案为:
;故答案为:![]() .
.


科目:高中化学 来源: 题型:
【题目】25 ℃时,分别向20.00 mL 0.100 0 mol·L-1的氨水、醋酸铵溶液中滴加0.100 0 mol·L-1的盐酸,溶液pH与加入盐酸体积的变化关系如图所示。下列说法正确的是( )
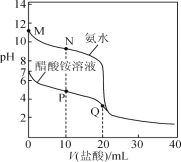
A.M点溶液中:c(OH-)>c(NH4+)>c(NH3·H2O)>c(H+)
B.N点溶液中:c(NH4+)>c(Cl-)>c(NH3·H2O)>c(OH-)
C.P点溶液中: c(NH4+)+c(NH3·H2O)<c(CH3COO-) +c(CH3COOH)
D.Q点溶液中:2c(Cl-)=c(CH3COOH)+c(NH4+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学研究小组探究外界条件对化学反应mA(g)+n(B)(g) ![]() pC(g)的速率和平衡的影响图像如下,下列判断正确的是( )
pC(g)的速率和平衡的影响图像如下,下列判断正确的是( )
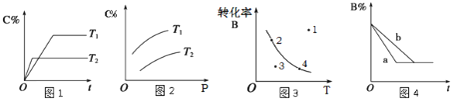
A.由图1可知,T1<T2,该反应正反应为吸热反应
B.由图2可知,该反应m+n<p
C.图3中,表示反应速率v(正)>v(逆)的是点3
D.图4中,若m+n=p,则a曲线一定使用了催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应①X(g)+2Y(g)![]() 2Z(g)、②2M(g)
2Z(g)、②2M(g)![]() N(g)+P(g)分别在密闭容器的两个反应室中进行,反应室之间有无摩擦、可滑动的密封隔板。反应开始和达到平衡状态时有关物理量的变化如图所示:
N(g)+P(g)分别在密闭容器的两个反应室中进行,反应室之间有无摩擦、可滑动的密封隔板。反应开始和达到平衡状态时有关物理量的变化如图所示:
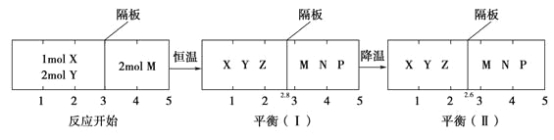
下列判断正确的是( )
A.反应①的正反应是吸热反应
B.达平衡(Ⅰ)时体系的压强与反应开始时体系的压强之比为14:15
C.达平衡(Ⅱ)时,X的转化率为![]()
D.在平衡(Ⅰ)和平衡(Ⅱ)中,M的体积分数相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,发生可逆反应:4NH3(g)+5O2(g) ![]() 4NO(g)+6H2O(g),下列叙述中,不能作为此可逆反应已经达到化学平衡状态的标志的是
4NO(g)+6H2O(g),下列叙述中,不能作为此可逆反应已经达到化学平衡状态的标志的是
A.NH3的消耗速率等于NO的生成速率
B.NH3的消耗速率等于NO的消耗速率
C.NH3的浓度和NO的浓度都不发生改变
D.密闭容器内的压强不发生改变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质的量相同的下列各物质,分别在足量的O2中完全燃烧,其中耗氧量相同的一项是
A.CH3OH和C3H6B.C3H7COOH和
C.C2H5CHO和C3H4D.C3H8和C4H6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中,正确的是![]()
![]() 明矾可用于水的消毒净化;碳酸钡不可用于钡餐透视
明矾可用于水的消毒净化;碳酸钡不可用于钡餐透视
![]() 氮氧化物和碳氢化合物是构成光化学烟雾的重要物质
氮氧化物和碳氢化合物是构成光化学烟雾的重要物质
![]() 氨常用作制冷剂,是因为其沸点极低,很容易液化
氨常用作制冷剂,是因为其沸点极低,很容易液化
![]() 硅的提纯与应用,促进了半导体元件与集成芯片的发展,可以说“硅是信息技术革命的催化剂”
硅的提纯与应用,促进了半导体元件与集成芯片的发展,可以说“硅是信息技术革命的催化剂”
(5)SiCl4在战争中常用作烟雾弹,是因为它水解时生成白色烟雾
![]() 通电时,溶液中溶质粒子分别向两极移动,胶体中胶粒向某一极移动
通电时,溶液中溶质粒子分别向两极移动,胶体中胶粒向某一极移动
![]() 铝粉和氧化镁粉末混合,高温能发生铝热反应
铝粉和氧化镁粉末混合,高温能发生铝热反应
![]() 高纯度的二氧化硅广泛用于制作光导纤维,光导纤维遭遇强碱会“断路”
高纯度的二氧化硅广泛用于制作光导纤维,光导纤维遭遇强碱会“断路”
![]() 可用稀盐酸、碳酸钠溶液、硅酸钠溶液设计实验来验证元素的非金属性
可用稀盐酸、碳酸钠溶液、硅酸钠溶液设计实验来验证元素的非金属性
![]() 同主族元素的简单阴离子还原性越强,水解程度越大
同主族元素的简单阴离子还原性越强,水解程度越大
(11)Al2O3在工业上用于制作耐高温材料,也用于电解法治炼铝.
A.3句B.4句C.5句D.6句
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知元素周期表中共有18个纵行,下图实线表示元素周期表的边界。按核外电子排布,可把元素周期表里的元素划分为![]() 区、
区、![]() 区、
区、![]() 区、
区、![]() 区等。除
区等。除![]() 区外,其他区的名称来自按构造原理最后填入电子的能级的符号。
区外,其他区的名称来自按构造原理最后填入电子的能级的符号。

(1)请在上图中用实线画出![]() 区、
区、![]() 区、
区、![]() 区、
区、![]() 区的边界线,并分别用阴影
区的边界线,并分别用阴影![]() 和
和![]() 表示
表示![]() 区和
区和![]() 区________。
区________。
(2)有的同学受这种划分的启发,认为![]() 区内第6、7纵行的部分元素可以排在另一区,你认为应排在______区。
区内第6、7纵行的部分元素可以排在另一区,你认为应排在______区。
(3)请在上述元素周期表中用元素符号标出![]() 轨道处于半充满状态的元素________。
轨道处于半充满状态的元素________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在固定容积的容器中,可逆反应A(g)+3B(g) ![]() 2C(g)达到平衡,此时测得n(A)∶n(B)∶n(C)=2∶2∶1。若保持温度不变,以n(A)∶n(B)∶n(C)=2∶2∶1的比例向该容器中再充入A、B和C,下列叙述正确的是
2C(g)达到平衡,此时测得n(A)∶n(B)∶n(C)=2∶2∶1。若保持温度不变,以n(A)∶n(B)∶n(C)=2∶2∶1的比例向该容器中再充入A、B和C,下列叙述正确的是
A. 刚充入时反应速率υ正减少,υ逆增大 B. 平衡不发生移动
C. 平衡向正反应方向移动,A的物质的量浓度减小 D. 物质C的质量分数增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com