
【题目】有机物R是金银花的一种成分,具有广谱抗病毒功效,键线式为 (已知CH2=CHCH2OH的键线式为
(已知CH2=CHCH2OH的键线式为![]() )。下列说法错误的是( )
)。下列说法错误的是( )
A.R能发生加成、氧化、取代反应
B.用酸性高锰酸钾溶液可以确认R含碳碳双键
C.R分子中所有碳原子可能共平面
D.![]() CHO与R互为同分异构体
CHO与R互为同分异构体
 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案 成功训练计划系列答案
成功训练计划系列答案 倍速训练法直通中考考点系列答案
倍速训练法直通中考考点系列答案 一卷搞定系列答案
一卷搞定系列答案 名校作业本系列答案
名校作业本系列答案科目:高中化学 来源: 题型:
【题目】最新研究表明As2O3在医药领域有重要应用。某小组从工业废料中提取As2O3设计流程如下:

已知:H3AsO3为弱酸,热稳定性差。
(1)写出一条“碱浸”时提高浸取率的方法____;“碱浸”中H3AsO3转化成Na3AsO3的离子方程式为____。
(2)“氧化”时常在向混合液中通入O2时对体系加压,目的是____。
(3)“沉砷”过程中有如下反应:
①![]()
![]() <0
<0
②![]()
![]() >0
>0
沉砷率与温度关系如图。沉砷最佳温度为____,高于85℃时,沉砷率下降的原因是____。

(4)“还原”过程中获得H3 AsO3的化学反应方程式为____;“操作A”为:____、过滤;滤液Ⅱ的主要成分是____。
(5)若每步均完全反应,“氧化’’和“还原”时消耗相同条件下O2和SO2体积分别为xL、yL,则废水中n(H3AsO3):n(H3AsO4)=____(写出含x、y的计算式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学——选修3:物质结构与性质]
氮的化合物在生产、生活中有广泛应用。
(1)氮化镓(GaN)是新型的半导体材料。基态氮原子的核外电子排布图为____;基态镓(Ga)原子的核外具有____种不同能量的电子。
(2)乙二氨的结构简式为(H2N-CH2-CH2-NH2,简写为en)。
①分子中氮原子轨道杂化类型为____;
②乙二氨可与铜离子形成配合离子[Cu(en)2]2+,其中提供孤电子对的原子是____,配合离子结构简式为____;
③乙二氨易溶于水的主要原因是____。
(3)氮化硼(BN)是一种性能优异、潜力巨大的新型材料,主要结构有立方氮化硼(如图1)和六方氮化硼(如图2),前者类似于金刚石,后者与石墨相似。

①图1中氮原子的配位数为____,离硼原子最近且等距离的硼原子有____个;
②已知六方氮化硼同层中B与N之间的距离为acm,密度为dgcm-3,则相邻层与层之间的距离为____pm(列出表达式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面列出了几组物质,请将物质的合适组号填写在空格上。同位素 ,同系物 ,同素异形体 ,同分异构体 。
①金刚石与“足球烯”C60; ②D与T; ③16O、17O和18O;④氧气(O2)与臭氧(O3); ⑤CH4和CH3CH2CH3;⑥乙醇(CH3CH2OH)和甲醚(CH3OCH3);
⑦![]() ⑧
⑧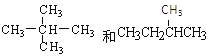
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒容密闭容器中投入1molC和1molBaSO4,一定温度下发生反应:3C(s)+BaSO4(s)![]() BaS(s)+2CO(g)+CO2(g)(注明:s代表固体,g代表气体)。下列情况下表明该反应达到最大限度(平衡状态)的是( )
BaS(s)+2CO(g)+CO2(g)(注明:s代表固体,g代表气体)。下列情况下表明该反应达到最大限度(平衡状态)的是( )
A.混合气体平均摩尔质量不再变化
B.CO的体积分数不再变化
C.硫酸钡浓度不再变化
D.混合气体密度不再变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】天然气是一种清洁能源和重要化工原料。
(1)下列事实能说明CH4分子呈正四面体结构的是___(填字母)。
A.CH4分子的4个C—H共价键键长相等
B.CH4分子中每个键角都是109°28′
C.CH2F2没有同分异构体
D.CCl4的沸点高于CH4的
(2)甲烷与下列烃的通式相同的是___(填字母)。

(3)已知断裂几种化学键要吸收的能量如下:
化学键 | C—H | O=O | C=O | H—O |
断裂1mol键吸收的能量/kJ | 415 | 497 | 745 | 463 |
16gCH4在O2中完全燃烧生成气态CO2和气态水时___(填吸收”或放出”)约___ kJ热量。
(4)天然气/空气燃料电池中,若KOH为电解质,负极反应式为___。等质量的甲烷分别以稀硫酸、KOH溶液为电解质溶液完全放电时,理论上提供的电能之比为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有常温时pH=1的某强酸溶液10mL,下列操作能使溶液的pH变成2的是( )
A. 加入10mL 0.08mol·L-1的NaOH溶液 B. 加入100mL 的水进行稀释
C. 加水稀释成1L D. 加入10mL 0.01mol·L-1的盐酸溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由A、B、C、D四种金属按下表中装置进行实验。
装置 |
|
|
|
现象 | 二价金属A不断溶解 | C的质量增加 | A上有气体产生 |
根据实验现象回答下列问题:
(1)装置甲中负极的电极反应式是______________________________________。
(2)装置乙中正极的电极反应式是_______________________________________。
(3)装置丙中溶液的pH________(填“变大”、“变小”或“不变”)。
(4)四种金属活动性由强到弱的顺序是___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化钾样品中含有少量碳酸钾、硫酸钾和不溶于水的杂质。为了提纯氯化钾,先将样品溶于适量水中,充分搅拌后过滤,再将滤液按下图所示步骤进行操作。提示:图中A代表沉淀或者溶液

(1)检验提纯后的KCl中是否还含有SO42-的方法是____________________________。
(2)用提纯后的KCl配制980 mL 1.00 mol/L的氯化钾溶液,回答下列问题:
①根据计算,所需称量的KCl的质量为__________。
②容量瓶上标有:①温度、②浓度、③容量、④压强、⑤刻度线这五项中的______。(填数字符号)
③下列操作会使所配溶液浓度偏低的是__________(填选项代号)。
A.配制前容量瓶内壁刻度线以下存有水珠 B.没有洗涤烧杯内壁
C.转移溶液时部分溶液溅出容量瓶外 D.定容时俯视
(3)试剂Ⅰ的名称为______,试剂Ⅱ的化学式为______,试剂Ⅲ的化学式为_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com