
| 1.68L |
| 22.4L/mol |
| 6.6g |
| 44g/mol |
| 2.7g |
| 18g/mol |


科目:高中化学 来源: 题型:
| A、CH3-CH2-CH3和CH3-CH2-CH2-CH3 |
| B、CH3-CH=CH-CH3和CH2=CH-CH2-CH3 |
| C、CH3-CH=CH-CH3和CH3-CH2-CH3 |
| D、CH3-CH=CH-CH3和CH3-CH2-CH2-CH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温下,5.6g铁与足量的稀盐酸反应失去的电子数为0.3NA |
| B、11.2L CO2与8.5g NH3所含的分子数相等 |
| C、2g Na2O溶于水后,所得溶液中O2-个数为0.1NA |
| D、100mL 1mol?L-1 Na2SO4溶液中含Na+个数为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实 验 要 求 | 试剂及方法 |
| 除去KI中少量I2 | |
| 鉴别Na2CO3和K2CO3 | |
| 鉴别 SO2和CO2气体 | |
| 判断CH4中是否含有C2H4 | |
| 证明NH3.H2O溶液呈碱性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
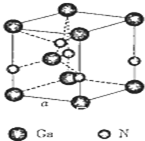 以氮化镓(GaN)为代表的第三代半导体材料目前已成为全球半导体研究的前沿和热点.回答下列问题:
以氮化镓(GaN)为代表的第三代半导体材料目前已成为全球半导体研究的前沿和热点.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
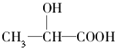 .已知有机物中若含有相同的官能团,则化学性质相似.完成下列问题:
.已知有机物中若含有相同的官能团,则化学性质相似.完成下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
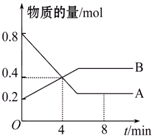 某温度时,在2L容器中A、B两种物质间的转化反应中,A、B物质的量随时间变化的曲线如图所示,由图中数据分析得:
某温度时,在2L容器中A、B两种物质间的转化反应中,A、B物质的量随时间变化的曲线如图所示,由图中数据分析得:查看答案和解析>>
科目:高中化学 来源: 题型:
A、Fe2O3+3CO
| ||||
| B、CO2+H2O═H2CO3 | ||||
C、CuO+H2
| ||||
D、2Na+O2
|
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com