
��֪����������Ԫ��X��Y��Z��W��ԭ����������������X��Y��ԭ������֮�͵���Z��ԭ��������X��Z���γ�X2Z��X2Z2���ֻ����W�Ƕ���������Ԫ���а뾶����Ԫ�ء�
��1��W�����ڱ��е�λ�ã� ��
��2����һ�������£��ݻ�Ϊ1L�ܱ������м���1.2molX2��0.4molY2 ���������·�Ӧ��
3X2 (g) + Y2(g) ![]() 2YX3(g) ��H
2YX3(g) ��H
��Ӧ�����ʵ���Ũ����ʱ��仯���£�
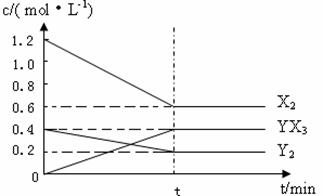
�ټ�����¶��´˷�Ӧ��ƽ�ⳣ��K= ��
���������¶�ƽ�ⳣ��K��С������H 0���>������<����=������
�۸ı�������������ʹ��ƽ��������Ӧ�����ƶ���ƽ�ⳣ��������� ������ĸ����
a.����ѹǿ b. �����¶� c.ʹ�ô��� d. ����Ӧ���Ũ��
��3������Һ̬������X2Z2��ϡ��Һ�ױ����ֽ⣬��ʹ�õĴ���Ϊ ������ĸ����
a��MnO2 b��FeCl3 c��Na2SO3 d��KMnO4
��4��A������Ԫ��������Ԫ����ɵĵ���ʣ���Һ�ʼ��ԣ���������0.1mol��L��1��A��Һϡ����ԭ�����10������Һ��pH=12����A�ĵ���ʽΪ ��
��5����X2Ϊȼ�Ͽ��Ƴ�ȼ�ϵ�ء���֪��2X2(g)+Z2(g)=2X2Z(l) ��H=−572KJ��mol��1
��ȼ�ϵ���ͷ�228��8KJ����ʱ������1molҺ̬X2Z���õ�ص�����ת����Ϊ ��
 ���ɶ��ȫ���ƿؾ�ϵ�д�
���ɶ��ȫ���ƿؾ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A������Ԫ�ؾ����γɲ�ͬ��ͬ�������� | B��X��Y��W�ֱ�����γ�XY2��XW2������ | C���⻯���ȶ�����ǿ�������ǣ�Q��W��Z��X | D��W�γɼ������Ӱ뾶С��Q�γɼ������Ӱ뾶 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
(11��)��֪����������Ԫ��X��Y��Z��W��ԭ����������������X��Y��ԭ������֮�͵���Z��ԭ��������X��Z���γ�X2Z��X2Z2���ֻ����W�Ƕ���������Ԫ���а뾶����Ԫ�ء�
��W�����ڱ��е�λ�ã� ��
����һ�������£��ݻ�Ϊ1L�ܱ������м���1.2molX2��0.4molY2���������·�Ӧ��
3X2 (g) + Y2(g) 2YX3(g) ��H ��Ӧ�����ʵ���Ũ����ʱ��仯���£�
�ٴ˷�Ӧ��ƽ�ⳣ������ʽΪ (�û�ѧʽ��ʾ) �� K= ��
���������¶�ƽ�ⳣ��K��С�����H 0(�����)��
��A1������Ԫ��������Ԫ����ɵĵ���ʣ���Һ�ʼ��ԣ���0.1mol��L-1��A1��Һϡ����ԭ�����10������Һ��pH=12����A1�ĵ���ʽΪ ��
��B1��B2��������Ԫ�������γɵ�ǿ����ʣ�����Һ�����ԣ���ͬŨ��ʱB1��Һ��ˮ�ĵ���̶�С��B2��Һ��ˮ�ĵ���̶ȣ���ԭ���� ��
��A2��B1��Ӧ����B2����0.2mol/LA2��0.1mol/LB1�������Ϻ���Һ������Ũ�ȴ�С��ϵΪ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2011-2012ѧ�꼪��ʡ������ʮһ���и�һ��ѧ����ĩ���Ի�ѧ�Ծ����������� ���ͣ������
��13�֣���֪����������Ԫ��X��Y��Z��W��ԭ����������������X��Y��ԭ������֮�͵���Z��ԭ��������X��Z���γ�X2Z��X2Z2���ֻ����W�Ƕ���������Ԫ���а뾶����Ԫ�ء�
��1��W�����ڱ��е�λ�ã� ��
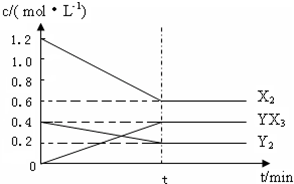
��2����һ�������£��ݻ�Ϊ1L�ܱ������м���1.2molX2��0.4molY2���������·�Ӧ��
3X2 (g) + Y2(g) 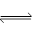 2YX3(g) ��H
2YX3(g) ��H
��Ӧ�����ʵ���Ũ����ʱ��仯���£�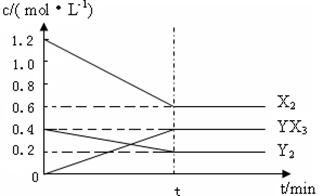
�ټ�����¶��´˷�Ӧ��ƽ�ⳣ��K= ��
���������¶�ƽ�ⳣ��K��С������H 0���>������<����=������
�۸ı�������������ʹ��ƽ��������Ӧ�����ƶ���ƽ�ⳣ��������� ������ĸ����
a.����ѹǿ b. �����¶� c.ʹ�ô��� d. ����Ӧ���Ũ��
��3������Һ̬������X2Z2��ϡ��Һ�ױ����ֽ⣬��ʹ�õĴ���Ϊ ������ĸ����
a��MnO2 b��FeCl3 c��Na2SO3 d��KMnO4
��4��A������Ԫ��������Ԫ����ɵĵ���ʣ���Һ�ʼ��ԣ���������0.1mol��L��1��A��Һϡ����ԭ�����10������Һ��pH=12����A�ĵ���ʽΪ ��
��5����X2Ϊȼ�Ͽ��Ƴ�ȼ�ϵ�ء���֪��2X2(g)+Z2(g)=2X2Z(l) ��H=?572KJ��mol��1
��ȼ�ϵ���ͷ�228��8KJ����ʱ������1molҺ̬X2Z���õ�ص�����ת����Ϊ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014�켪��ʡ�����и�һ��ѧ����ĩ���Ի�ѧ�Ծ��������棩 ���ͣ������
��13�֣���֪����������Ԫ��X��Y��Z��W��ԭ����������������X��Y��ԭ������֮�͵���Z��ԭ��������X��Z���γ�X2Z��X2Z2���ֻ����W�Ƕ���������Ԫ���а뾶����Ԫ�ء�
��1��W�����ڱ��е�λ�ã� ��
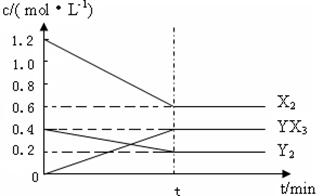
��2����һ�������£��ݻ�Ϊ1L�ܱ������м���1.2molX2��0.4molY2 ���������·�Ӧ��
3X2 (g) + Y2(g)
 2YX3(g) ��H
2YX3(g) ��H
��Ӧ�����ʵ���Ũ����ʱ��仯���£�
�ټ�����¶��´˷�Ӧ��ƽ�ⳣ��K= ��
���������¶�ƽ�ⳣ��K��С������H 0���>������<����=������
�۸ı�������������ʹ��ƽ��������Ӧ�����ƶ���ƽ�ⳣ��������� ������ĸ����
a.����ѹǿ b. �����¶� c.ʹ�ô��� d. ����Ӧ���Ũ��
��3������Һ̬������X2Z2��ϡ��Һ�ױ����ֽ⣬��ʹ�õĴ���Ϊ ������ĸ����
a��MnO2 b��FeCl3 c��Na2SO3 d��KMnO4
��4��A������Ԫ��������Ԫ����ɵĵ���ʣ���Һ�ʼ��ԣ���������0.1mol��L��1��A��Һϡ����ԭ�����10������Һ��pH=12����A�ĵ���ʽΪ ��
��5����X2Ϊȼ�Ͽ��Ƴ�ȼ�ϵ�ء���֪��2X2(g)+Z2(g)=2X2Z(l) ��H=−572KJ��mol��1
��ȼ�ϵ���ͷ�228��8KJ����ʱ������1molҺ̬X2Z���õ�ص�����ת����Ϊ ��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com