
25℃时,在20 ml 0.1mol·L-1NaOH溶液中逐滴加入0.2 mol·L-1醋酸溶液,曲线如图所示,有关粒子浓度关系的比较中,不正确的是( )
|
B.在B点:c(OH-)﹦c(H+),c(Na+)﹦c(CH3COO-)
C.在C点:c(CH3COO-)﹥c(Na+)﹥c(H+) ﹥c(OH-)
D.在C点:c(CH3COO-)+c(CH3COOH)﹦2 c(Na+)
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:阅读理解
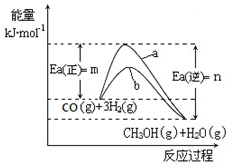
 CH3OH(g)+H2O(g)△H=-(n-m)kJ?mol-1
CH3OH(g)+H2O(g)△H=-(n-m)kJ?mol-1 CH3OH(g)+H2O(g)△H=-(n-m)kJ?mol-1
CH3OH(g)+H2O(g)△H=-(n-m)kJ?mol-1
| 16 |
| 3 |
| 16 |
| 3 |
 CH3CH2OH(g)+3H2O(g) 25℃时,K=2.95×1011
CH3CH2OH(g)+3H2O(g) 25℃时,K=2.95×1011 |
500 | 600 | 700 | 800 |
| 1.5 | 45 | 33 | 20 | 12 |
| 2.0 | 60 | 43 | 28 | 15 |
| 3.0 | 83 | 62 | 37 | 22 |
 ①温度升高,K值
①温度升高,K值查看答案和解析>>
科目:高中化学 来源: 题型:
| 容器代码 | A | B | C | D | ||
平衡时
|
16 | 17 | ||||
| 平衡时N2转化率 | 20% | ① | ② | ③ | ||
| 平衡时H2转化率 | 30% |
查看答案和解析>>
科目:高中化学 来源:四川省攀枝花市2012-2013学年高一下学期期末调研监测化学试题 题型:022
下列化合物:
①HCl
②NaOH
③CH3COOH
④NH3·H2O
⑤CH3COONa
⑥NH4Cl
(1)属于弱电解质的是________(填序号),溶液呈酸性的有________(填序号).
(2)25℃时,0.10 mol/LCH3COONa溶液pH=11,该溶液中离子浓度按由大到小的顺序为________.
(3)将等pH等体积的HCl和CH3COOH分别稀释m倍和n倍,若稀释后两溶液的PH仍相等,则m________n(填“大于、等于、小于”).
(4)25℃时,在20 mL0.1 mol/L醋酸溶液加入VmL0.1 mol/LNaOH溶液,测得混合溶液的pH变化曲线如图所示,下列说法正确的是________.
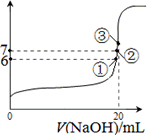
A.pH=3的醋酸溶液和pH=11的醋酸钠溶液中,水的电离程度相同
B.①点时pH=6,此时溶液中,c(CH3COO-)-c(Na+)=9.9×10-7 mol/L
C.②点时,溶液中的c(CH3COO-)=c(Na+)
D.③点时V=20 mL,此时溶液中c(CH3COO-)>c(Na+)
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
(一)(6分) 将2.5g碳酸钠、碳酸氢钠和氢氧化钠固体混合物完全溶解于水,制成稀溶液,然后向该溶液中逐滴加入1mol/L的盐酸,所加入盐酸的体积与产生CO2的体积(标准状况)关系如下图所示:
(1)写出OA段所发生反应的离子方程式
(2)当加入35mL盐酸时,产生二氧化碳的体积为 mL(标准状况)
(3)原混合物中Na2CO3的质量分数为 。
(二).氨是重要的氮肥,是产量最大的化工产品之一。课本里介绍的合成氨技术叫哈伯法,是德国化学家哈伯在1905年发明的,其合成原理为:N2(g) + 3H2(g)![]() 2NH3(g);
2NH3(g);
△H=―92.4 kJ/mol,他因此获得了1918年度诺贝尔化学奖。试回答下列问题:
⑴ 下列方法不适合实验室制取氨气的是 (填序号)。
A.向生石灰中滴入浓氨水 B.加热浓氨水
C.直接用氢气和氮气合成 D.向饱和氯化铵溶液中滴入浓氢氧化钠溶液
⑵ 合成氨工业中采取的下列措施可用勒夏特列原理解释的是 (填序号)。
A.采用较高压强(20 M Pa~50 M Pa)
B.采用500℃的高温
C.用铁触媒作催化剂
D.将生成的氨液化并及时从体系中分离出来,未反应的N2和H2循环到合成塔中
(3) 用数字化信息系统DIS(如下图Ⅰ所示:它由传感器、数据采集器和计算机组成)可以测定上述氨水的浓度。用酸式滴定管准确量取0.5000 mol/L醋酸溶液25.00 mL于烧杯中,以该种氨水进行滴定,计算机屏幕上显示出溶液导电能力随氨水体积变化的曲线如下图Ⅱ所示。
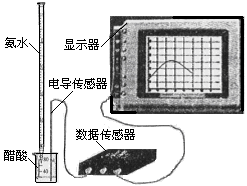
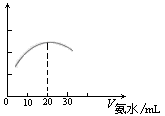
图Ⅰ 图Ⅱ
① 用滴定管盛氨水前,滴定管要用 润洗2~3遍,
② 试计算该种氨水的浓度: 。
③ 下列情况下,会导致实验结果c(NH3·H2O)偏低的是 。
A.滴定结束时仰视读数
B.量取25.00 mL醋酸溶液时,未用所盛溶液润洗滴定管
C.滴定时,因不慎将氨水滴在烧杯外
(4) 1998年希腊亚里士多德大学的Marnellos和Stoukides采用高质子导电性的SCY陶瓷(能传递H+),实现了高温常压下高转化率的电化学合成氨。其实验装置如下图。
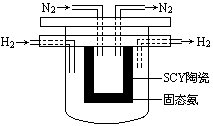
正极的电极反应式为: 。
查看答案和解析>>
科目:高中化学 来源:2012届浙江省高二下学期期末考试化学试卷 题型:选择题
右下图装置可用于多项定量实验。图中夹持固定装置已略去,甲有刻度,供量气用。
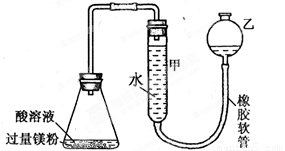
( 1 )装置中有刻度的甲管可以用______________代替 (填仪器名称),按图连接好装置后,检查装置气密性的方法是______________________________
( 2 )某实验小组用镁粉、盐酸、醋酸设计实验来证明:在同温同压下,当上述两种酸的物质的量相同时,与镁粉反应生成氢气的体积相同而反应速率不同。装置如右图所示,
有关实验数据记录于下表:
|
酸溶液 |
酸溶液 |
气体体积/mL |
反应时间 |
|
|
(实验A) |
(实验B) |
(25℃、101 kPa) |
实验A |
实验B |
|
CH3COOH 0.1 mol/L 40.00mL |
HCl溶液 0.1 mol/L 40.00mL |
5 |
t(a1)=155 s |
t(b1)=7 s |
|
10 |
t(a2)=310 s |
t(b2)=16 s |
||
|
15 |
t(a3)=465 s |
t(b3)=30 s |
||
|
20 |
t(a4)=665 s |
t(b4)=54 s |
||
|
…… |
…… |
…… |
请回答下列问题:
①每次实验至少需要用电子天平(能称准1 mg) 称取镁粉___________________g;
②冷却到25℃后,在读取气体体积时,首先应如何操作:__________________________;
③分析实验数据,t(a1)远远大于t(b1)的原因是__________________________。
(3)用图示装置,某同学设计了测定镀锌铁皮镀层厚度的实验方案,将单侧面积为S cm2、质量为m g的镀锌铁皮与6mol·L—1 NaOH溶液反应。回答下列问题:(已知锌的密度为 ρ g/cm3)
① 写出Zn镀层与NaOH溶液反应的离子方程式________________________________________
②为提高测定的准确性,需将锥形瓶上的单孔橡胶塞换为双孔橡胶塞,另一孔插入______(填仪器名称)
实验时先向锥形瓶中加入镀锌铁皮样品,塞上双孔塞,再加入NaOH溶液;
③ 已知实验前后甲管中液面读数差为V mL(实验条件的气体摩尔体积为Vm mol·L—1)。则镀锌铁皮的锌镀层厚度为_________________________cm。(写出数学表达式)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com