
| 物 质 | 所需试剂 | 离子方程式 |
| FeSO4(CuSO4) | ||
| Na2SO4(NaHCO3) | . |
科目:高中化学 来源: 题型:选择题
| A. | 松花蛋 | B. | 纯净水 | C. | 可乐 | D. | 馒头 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
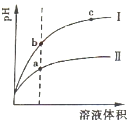 常温下有0.1mol•L-1四种溶液NaOH、NH3•H2O、HCl、CH3COOH
常温下有0.1mol•L-1四种溶液NaOH、NH3•H2O、HCl、CH3COOH查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 100mL0.5mol•L-1MgCl2溶液 | B. | 100mL0.5mol•L-1 HCl溶液 | ||
| C. | 200mL0.25mol•L-1 KCl溶液 | D. | 100mL0.5mol•L-1NaClO溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N2和NCl3两种分子中,每个原子的最外层都具有8电子稳定结构 | |
| B. | CO2和SiO2的熔沸点和硬度差异很大,是由于它们所含的化学键类型不同 | |
| C. | 某些金属与非金属原子间能形成共价键 | |
| D. | F2、Cl2、Br2、I2的熔、沸点逐渐升高,是因为分子间作用力越来越大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 醋酸亚铁 | B. | 硫酸亚铁 | C. | 氧化铁 | D. | 氯化铁 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 降低大气中CO2的含量及有效地开发利用 CO2,目前工业上有一种方法是用CO2来生产燃料甲醇.为探究反应原理,现进行如下实验,在体积为1L的恒容密闭容器中,充入1mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ/mol.测得CO2和CH3OH(g)的浓度随时间变化如图所示.
降低大气中CO2的含量及有效地开发利用 CO2,目前工业上有一种方法是用CO2来生产燃料甲醇.为探究反应原理,现进行如下实验,在体积为1L的恒容密闭容器中,充入1mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ/mol.测得CO2和CH3OH(g)的浓度随时间变化如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:实验题

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
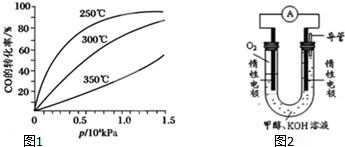
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com