
(2000·上海)已知维生素A的结构简式可写为: ,式中以线示键,线的交点与端点处代表碳原子,并且氢原子数补足四价,但C、H原子未标记出来.关于它的叙述正确的是
,式中以线示键,线的交点与端点处代表碳原子,并且氢原子数补足四价,但C、H原子未标记出来.关于它的叙述正确的是
[ ]
A.维生素A的分子式为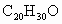
B.维生素A是一种易溶于水的醇
C.维生素A分子中含有异戊二烯的碳链结构
D.1mol维生素A在催化剂作用下最多可与7mol 发生加成反应
发生加成反应
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解

| 实 实验过程 | 实验现象 | 有关化学方程式 | ||||||||||||||||
| 在C中加入样品标本W克,D中装入药品后并称量为m1克.连接好仪器后,检查气密性 | B、E中有气泡产生 B、E中有气泡产生 |
2H2O2
2H2O2
| ||||||||||||||||
| 打开A的活塞,慢慢滴加溶液. | C中的红褐色粉末变成黑色 C中的红褐色粉末变成黑色 |
2Cu+O2
2Cu+O2
| ||||||||||||||||
| 对C进行加热.当C中药品充分反应后.关闭A的活塞.停止加热: | 无 无 |
无 无 | ||||||||||||||||
| 冷却后,称量D的质量为m2克. | 无 无 |
无 无 |
W-(m2-m1)×
| ||
| W |
W-(m2-m1)×
| ||
| W |
查看答案和解析>>
科目:高中化学 来源: 题型:

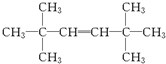
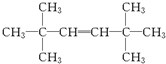
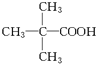

查看答案和解析>>
科目:高中化学 来源: 题型:
| Ⅰ | Ⅱ | Ⅲ | Ⅳ | |
| 盐酸液的体积(mL) | 30 | 30 | 30 | 30 |
| 样品(g) | 3.32 | 4.15 | 5.81 | 7.47 |
| 二氧化碳的体积(mL) | 672 | 840 | 896 | 672 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com