
| A. | 木炭的燃烧 | B. | 氢氧化钡晶体与氯化铵晶体混合 | ||
| C. | 镁条与稀硫酸的反应 | D. | 生石灰溶于水 |
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | VA=0.15 mol•L-1•min-1 | B. | VB=0.6 mol•L-1•min-1 | ||
| C. | VC=0.4 mol•L-1•min-1 | D. | VD=0.1 mol•L-1•min-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
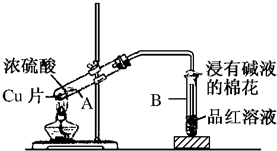
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,Y
,Y .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
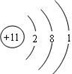 ;F元素在周期表中的位置是第三周期ⅦA族;
;F元素在周期表中的位置是第三周期ⅦA族;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
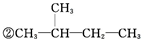 ③CH2=CH2④
③CH2=CH2④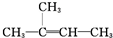 ⑤CH≡CH⑥CH3-C≡CH ⑦CH3-Cl ⑧CH3-CH2-Br⑨CH3-OH ⑩CH3-CH2-OH⑪CH3-COOH⑫CH3-COO-CH2-CH3⑬
⑤CH≡CH⑥CH3-C≡CH ⑦CH3-Cl ⑧CH3-CH2-Br⑨CH3-OH ⑩CH3-CH2-OH⑪CH3-COOH⑫CH3-COO-CH2-CH3⑬ ⑭
⑭ ⑮
⑮ ⑯
⑯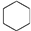
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com