
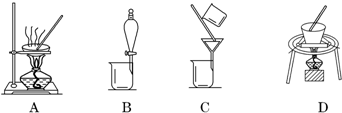
| A. | 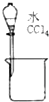 分离水和CCl4 | B. | 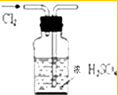 干燥Cl2 干燥Cl2 | C. | 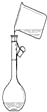 转移溶液 | D. | 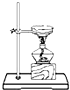 蒸发食盐水 |
科目:高中化学 来源: 题型:填空题
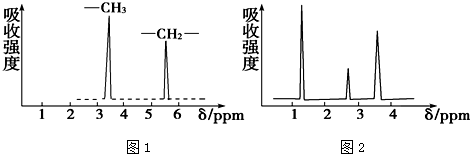
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ag、Cu两种单质的混合物 | B. | Cu、Fe两种单质的混合物 | ||
| C. | Ag、Fe两种单质的混合物 | D. | Ag、Cu、Fe三种单质的混合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
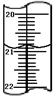 加碘食盐是在食盐中添加碘酸钾,当食盐含碘量(以I计算)超过20~50mg/kg,将对人体造成危害,所以检测食盐含碘量是保障加碘食盐质量的一项重要工作.
加碘食盐是在食盐中添加碘酸钾,当食盐含碘量(以I计算)超过20~50mg/kg,将对人体造成危害,所以检测食盐含碘量是保障加碘食盐质量的一项重要工作.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③⑤ | B. | ①③⑦ | C. | ④⑥ | D. | ③ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
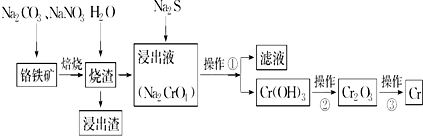
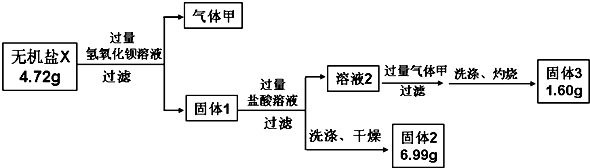
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
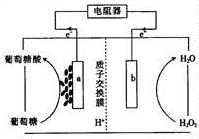 酶生物电池通常以葡萄糖作为反应原料,葡萄糖在葡萄糖氧化酶(GOX)和辅酶的作用下被氧化成葡萄糖酸(C6H1207),其工作原理如图所示.下列有关说法中正确的是( )
酶生物电池通常以葡萄糖作为反应原料,葡萄糖在葡萄糖氧化酶(GOX)和辅酶的作用下被氧化成葡萄糖酸(C6H1207),其工作原理如图所示.下列有关说法中正确的是( )| A. | 该电池可以在高温条件下使用 | |
| B. | H+通过交换膜从b极区移向a极区 | |
| C. | 电极a是正极 | |
| D. | 电池负极的电极反应式为C6H1206+H20-2e一═C6H1207+2H+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com