
下列各组物质,既不是同位素,又不是同素异形体,也不是同分异构体的是( )
A.白磷与红磷 B.12C与14C
C.正丁烷和异丁烷 D.乙烷和乙炔
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
英国物理学家约翰·丁达尔首先发现了入射光透过胶体时,从侧面可以看到一条光亮的通路。下列液体中,不会出现丁达尔效应的分散系的是 ( )。
①鸡蛋白溶液 ②蒸馏水 ③淀粉溶液 ④硫酸钠溶液
⑤沸水中滴入饱和FeCl3溶液 ⑥肥皂水
A.② B.①③
C.⑤⑥ D.④
查看答案和解析>>
科目:高中化学 来源: 题型:
2013年4月22日是第44个“世界地球日”。我国的主题是“珍惜地球资源,转变发展方式——促进生态文明 共建美丽中国”。下列说法中与“世界地球日”的主题无关的是 ( )。
A.减少CO2的排放量,以降低温室效应对地球的影响
B.开发利用太阳能、水力发电等无污染能源
C.燃料脱硫以减少酸雨的产生
D.我国政府已向全世界承诺:在全国消灭碘缺乏病
查看答案和解析>>
科目:高中化学 来源: 题型:
聚合氯化铝晶体是介于AlCl3和Al(OH)3之间的一种水溶性无机高分子聚合物,其制备原料主要是铝加工行业的废渣——铝灰,它主要含Al2O3、Al,还有SiO2等杂质。聚合氯化铝生产的工艺流程如下:
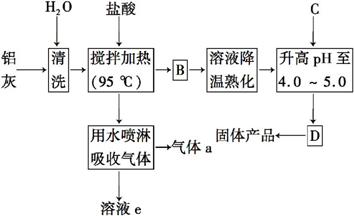
(1)反应中副产品a是 (用化学式表示)。
(2)升高pH至4.0~5.0的目的是______ 。
(3)生产过程中可循环使用的物质是 (用化学式表示)。
(4)为使得到的晶体较纯净,生产过程中使pH升高的C物质可选用 (填编号)。
a.NaOH b.Al c.氨水 d.Al2O3 e.NaAlO2
(5)聚合氯化铝晶体的化学式可表示为
[Al2(OH)nCl6-n·xH2O]m,实验室测定n的值:
①称取ag晶体,制成粉末,加热至质量不再变化为止,称量为bg。此过程可能用到的下列仪器有______ 。
a.蒸发皿 b.坩埚 c.研钵 d.试管
②另取ag晶体,进行如下操作:
用A试剂溶解→加足量AgNO3溶液→C操作→烘干→称量为cg。A试剂为_______(填试剂名称),C操作为 (填操作名称)。n= (用含b、c的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述正确的是( )
A.同周期元素中ⅦA族元素的相对原子质量最大
B.ⅥA族元素的原子,其半径越大,越容易得到电子
C.同周期中ⅠA族元素的金属性比ⅡA族元素的金属性强
D.所有主族元素的原子,形成单原子离子时的化合价和它的族序数相等
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C为短周期元素,在周期表中所处的位置如图所示。

A、C两元素原子核外电子数之和等于B原子的质子数,B原子核内质子数和中子数相等。
(1)写出A、B、C三种元素的符号:
A________,B________,C________。
(2)B位于元素周期表中第________周期,第________族。
(3)A的原子结构示意图为________。
(4)比较B、C的简单离子的半径________,写出A的气态氢化物与B的最高价氧化物对应水化物反应的化学方程式________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述正确的是( )
A.植物通过光合作用将CO2转化为葡萄糖是太阳能转变成热能的过程
B.太阳能电池是把化学能转化为电能
C.物质燃烧一定是放热反应
D.氢能可以通过电解海水获得并大量推广使用
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)反应A+3B===2C+2D在四种不同情况下的反应速率分别为:
①v(A)=0.15 mol·L-1·s-1;
②v(B)=0.6 mol·L-1·s-1;
③v(C)=0.4 mol·L-1·s-1;
④v(D)=0.45 mol·L-1·s-1。
该反应进行的快慢顺序为________________。
(2)在密闭容器中进行可逆反应,A与B反应生成C,其反应速率分别为:v1、v2、v3(mol·L-1·s-1),且v1、v2、v3之间有如下关系:v2=3v1,v3=2v1,则此反应可表示为______________________。
(3)下列各项可以证明2HI(g)H2(g)+I2(g)已经达到平衡状态的是________。
①单位时间内生成n mol I2的同时生成n mol HI;
②一个H—H键断裂的同时有两个H—I键断裂;
③百分组成ω(HI)=ω(H2)时;
④反应速率v(H2)=v(I2)=v(HI)/2时;
⑤c(H2):c(I2) :c(HI)=1:1:2时;
⑥温度和体积一定,容器内压强不再变化时;
⑦温度和压强一定,混合气体的密度不再变化时;
⑧温度和体积一定,混合气体的颜色不再变化时。
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室要配制200mL 1mol/L NaOH溶液,请回答下列问题.
(1)用托盘天平称取氢氧化钠,其质量为克.
(2)实验开始前,需要检查容量瓶是否.
(3)下列主要操作步骤的正确顺序是.
①称取一定量的氢氧化钠,放入烧杯中,用适量的蒸馏水溶解;
②用胶头滴管向容量瓶中加入蒸馏水至凹液面与刻度线相切;
③待冷却至室温后,将溶液转移到容量瓶中;
④盖好瓶塞,反复上下颠倒,摇匀;
⑤用少量的蒸馏水洗涤烧杯内壁和玻璃棒2至3次,洗涤液转移到容量瓶中.
(4)在配制过程中,其他操作都正确,下列操作会引起所配溶液浓度偏低的是:(填序号)
①溶解NaOH固体的过程中,有少量溶液溅出烧杯
②容量瓶不干燥,含有少量蒸馏水
③用于溶解NaOH的烧杯、玻璃棒未洗涤
④定容摇匀后发现液体体积小于刻度线,未补加少量蒸馏水至刻度线
(5)如图是该同学转移溶液的示意图,图中的错误是
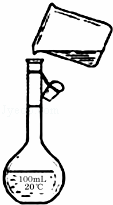
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com