

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ�ʵ����
 2NH3 ��g�� ������ӦΪ���ȷ�Ӧ��
2NH3 ��g�� ������ӦΪ���ȷ�Ӧ���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
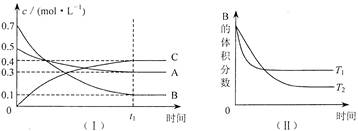
 CH3OH(g)�����������仯����ͼ�����ߢ��ʾʹ�ô���ʱ�������仯����Ͷ��a mol CO��2a mol H2��ƽ��ʱ������0.1a mol CH3OH����Ӧ�;߹�ҵӦ�ü�ֵ��
CH3OH(g)�����������仯����ͼ�����ߢ��ʾʹ�ô���ʱ�������仯����Ͷ��a mol CO��2a mol H2��ƽ��ʱ������0.1a mol CH3OH����Ӧ�;߹�ҵӦ�ü�ֵ��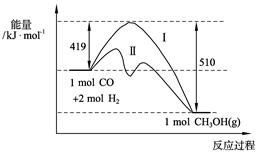
 CH3OH(g) ��H>��91 kJ��mol��1
CH3OH(g) ��H>��91 kJ��mol��1
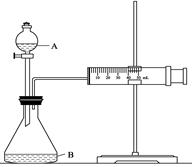
 ��
��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 CH3OH(g)��CO��ת����(��)���¶ȡ�ѹǿ�Ĺ�ϵ����ͼ��ʾ��
CH3OH(g)��CO��ת����(��)���¶ȡ�ѹǿ�Ĺ�ϵ����ͼ��ʾ��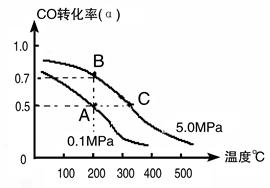
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 CH3CH2OH(g)+3H2O(g)��
CH3CH2OH(g)+3H2O(g)�� | | 500 | 600 | 700 | 800 |
| 1.5 | 45 | 33 | 20 | 12 |
| 2 | 60 | 43 | 28 | 15 |
| 3 | 83 | 62 | 37 | 22 |
 CH3OH��g��+ H2O��g����2minĩ�÷�Ӧ�ﵽƽ�⣬���CH3OH��Ũ��Ϊ0.2mol/L�������жϲ���ȷ���� ��
CH3OH��g��+ H2O��g����2minĩ�÷�Ӧ�ﵽƽ�⣬���CH3OH��Ũ��Ϊ0.2mol/L�������жϲ���ȷ���� ��
|
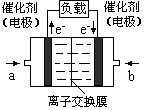
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������

 FeO(s)+CO(g) Fe(s)+CO2(g) ��H=-1kJ/mol��
FeO(s)+CO(g) Fe(s)+CO2(g) ��H=-1kJ/mol�� CO(g)+H2O(g) CO2(g)+H2(g) K=1.0
CO(g)+H2O(g) CO2(g)+H2(g) K=1.0�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
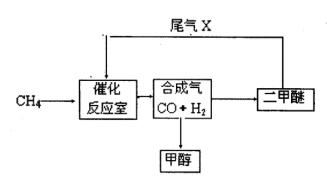
 ��2��β��ѭ�����漰�����·�Ӧ��CH4��g����H2O��g�� CO��g����3H2��g��,��д��ij�¶��¸÷�Ӧ��ƽ�ⳣ������ʽ ��
��2��β��ѭ�����漰�����·�Ӧ��CH4��g����H2O��g�� CO��g����3H2��g��,��д��ij�¶��¸÷�Ӧ��ƽ�ⳣ������ʽ �� ��Ӧ�� CO��g����2H2��g�� CH3OH��g��
��Ӧ�� CO��g����2H2��g�� CH3OH��g�� 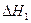
 ��Ӧ��CO2��g����3H2��g�� CH3��g����H2O��g��
��Ӧ��CO2��g����3H2��g�� CH3��g����H2O��g��
| �¶� | 250 | 300 | 350 |
| K | 2.041 | 0.270 | 0.012 |
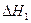 0���������������������������
0���������������������������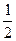 O2��g��
O2��g��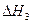 =��192.9kJ��mol��1
=��192.9kJ��mol��1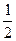 O2��g��
O2��g��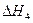 =��241.8kJ��mol��1
=��241.8kJ��mol��1 = ��
= ���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 2B(g),2B(g)
2B(g),2B(g) C(g)+2D(g)
C(g)+2D(g)�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��������������ڰ���������Ӧ |
| B���������мӼ�������S2�����ӵ����� |
| C����100�����ұ������¸�������FeCl3��ˮ�� |
| D����ѹ�����������ںϳɰ���Ӧ |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com