
 .
.
分析 A、B、C、D、E、F六种元素分属三个短周期,且原子序数依次增大,则A为H元素;A、D同主族,原子序数相差大于2,故D为Na,二者形成的离子化合物X为NaH;B的单质是空气中含量最高的物质,则B为N元素;C原子的最外层电子是次外层电子数的3倍,原子只能有2个电子层,最外层电子数为6,故C为O元素;D、E、F 且这3种元素的最高价氧化物的水化物两两皆能发生反应生成盐和水,应是氢氧化铝与强碱、强酸的反应,故E为Al,3种原子最外层共有11个电子,则F原子最外层电子数为11-1-3=7,故F为Cl;B的氢化物与F的氢化物反应生成离子化合物Y为NH4Cl,据此解答.
解答 解:A、B、C、D、E、F六种元素分属三个短周期,且原子序数依次增大,则A为H元素;A、D同主族,原子序数相差大于2,故D为Na,二者形成的离子化合物X为NaH;B的单质是空气中含量最高的物质,则B为N元素;C原子的最外层电子是次外层电子数的3倍,原子只能有2个电子层,最外层电子数为6,故C为O元素;D、E、F 且这3种元素的最高价氧化物的水化物两两皆能发生反应生成盐和水,应是氢氧化铝与强碱、强酸的反应,故E为Al,3种原子最外层共有11个电子,则F原子最外层电子数为11-1-3=7,故F为Cl;B的氢化物与F的氢化物反应生成离子化合物Y为NH4Cl.
(1)B元素为氮元素,B单质为N2,分子中N原子之间形成3对共用电子对,其结构式为N≡N,
故答案为:N≡N;
(2)用电子式表示化合物NaH的形成过程为: ,
,
故答案为: ;
;
(3)氨气和氯化氢反应生成离子化合物Y为NH4Cl,H2O2的电子式为 ,
,
故答案为:NH4Cl; ;
;
(4)D、F最高价氧化物的水化物分别为NaOH、HClO4,二者反应生成NaClO4与水,反应离子方程式为:OH -+H+=H2O,
故答案为:OH -+H+=H2O.
点评 本题考查位置结构性质关系应用,难度不大,推断元素是解题关键,侧重对化学用语的考查,注意理解掌握用电子式表示化学键或物质的形成.


 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案科目:高中化学 来源: 题型:选择题
| A. | 葡萄糖中的花青素在碱性环境下显蓝色,故可用苏打粉辨别真假葡萄酒 | |
| B. | 氨氮废水(含NH4+及NH3)可用化学氧化法或电化学氧化法处理 | |
| C. | 金属的防护中,牺牲阳极的阴极保护法利用的是原电池原理 | |
| D. | 84消毒液在日常生活中广泛应用,其有效成分是Ca(ClO)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 消去→加成→取代 | B. | 加成→消去→取代 | C. | 取代→消去→加成 | D. | 消去→加成→消去 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
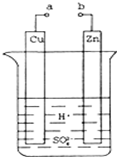 原电池是化学对人类的一项重大贡献.某兴趣小组为研究原电池原理,设计如图装置:
原电池是化学对人类的一项重大贡献.某兴趣小组为研究原电池原理,设计如图装置:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
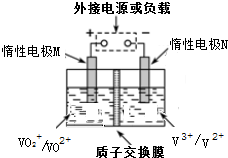 全钒液流储能电池是以溶解于一定浓度硫酸溶液中不同价态钒离子的氧化还原反应来实现化学能和电能相互转化,充电时,惰性电极M、N分别连接电源的正极和负极.电池工作原理如图所示,下列说法不正确的是( )
全钒液流储能电池是以溶解于一定浓度硫酸溶液中不同价态钒离子的氧化还原反应来实现化学能和电能相互转化,充电时,惰性电极M、N分别连接电源的正极和负极.电池工作原理如图所示,下列说法不正确的是( )| A. | 放电过程中,M电极反应为V02++2H++e一=V02++H20 | |
| B. | 放电过程中,质子通过交换膜从负极区移向正极区 | |
| C. | 充电过程中,N电极上V3+被还原为V2+ | |
| D. | 充电过程中,M电极附近酸性减弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
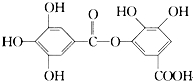
| A. | 它有酸性,1 mol该物质最多能与6 mol H2发生加成反应 | |
| B. | 在一定条件下,1 mol该物质最多能和4 mol Br2反应 | |
| C. | 它可以水解,水解产物为两种有机物 | |
| D. | 该有机物能发生取代反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
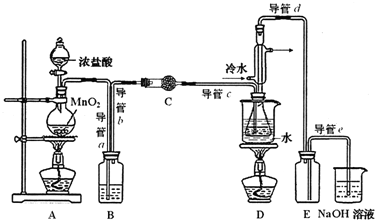
| 物质 | 熔点/℃ | 沸点/℃ | 密度/g•cm-3 | 溶解性 |
| S | 113 | 444 | 1.96 | 不溶于水 |
| S2C12 | -76 | 138 | 1.75 | 与水反应 |
| C S2 | -109 | 47 | 1.26 | 不溶于水 |
| CC14 | -23 | 77 | 1.59 | 不溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 0℃ | 10℃ | 20℃ | 30℃ | 40℃ | 50℃ | 60℃ | 100℃ | |
| NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 | 39.8 |
| NH4HCO3 | 11.9 | 15.8 | 21.0 | 27.0 | - | - | - | - |
| NaHCO3 | 6.9 | 8.1 | 9.6 | 11.1 | 12.7 | 14.5 | 16.4 | - |
| NH4Cl | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 | 55.3 | 77.3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com