
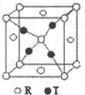
 X、Y、Z、R、T为周期表前四周期的元素,原子序数依次增大.X元素的一种核素无中子存在,Y的2p能级中有1个空轨道,Z的单质为空气的主要成分,R的最外层电子数为其内层电子数的3倍,T原子的价层电排布式是3d74s2.回答下列问题:
X、Y、Z、R、T为周期表前四周期的元素,原子序数依次增大.X元素的一种核素无中子存在,Y的2p能级中有1个空轨道,Z的单质为空气的主要成分,R的最外层电子数为其内层电子数的3倍,T原子的价层电排布式是3d74s2.回答下列问题: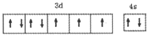 .
.| 电负性 | 原子半径 | 沸点 | 酸性 |
| Y<Z | Z>R | Y2X6<YX4R | XZR3>XZR2 |
分析 X、Y、Z、R、T为周期表前四周期的元素,原子序数依次增大.X元素的一种核素无中子存在,则X为H元素;Y的2p能级中有1个空轨道,原子核外电子排布式为1s22s22p2,故Y为C元素;R的最外层电子数为其内层电子数的3倍,原子只能有2个电子层,最外层电子数为6,故R为O元素;Z的单质为空气的主要成分,原子序数介于碳、氧之间,故Z为N元素;T原子的价层电排布式是3d74s2,则T为Co.
(1)结合泡利原理、洪特规则画出价层电子排布图;
(2)根据杂化轨道数目确定杂化方式,杂化轨道数目=σ键+孤对电子;
(3)同周期自左而右电负性增大;
同周期自左而右原子半径减小;
CH4O为甲醇,分子之间存在氢键,沸点高于C2H6 的,
非羟氧基数目越多,酸性越强;
(4)通过均摊法计算晶胞中R原子数目、T原子数目为4,原子的配位数之比与原子数目成反比;
(5)CoO放入足量的HCN溶液(呈弱酸性,分解温度1200℃)中,微热产生一种气体单质和[Co(CN)6]3-离子,Co的化合价升高,则发生还原反应得到气体单质,该气体单质为氢气,结合电荷守恒、原子守恒、电子转移守恒配平.
解答 解:X、Y、Z、R、T为周期表前四周期的元素,原子序数依次增大.X元素的一种核素无中子存在,则X为H元素;Y的2p能级中有1个空轨道,原子核外电子排布式为1s22s22p2,故Y为C元素;R的最外层电子数为其内层电子数的3倍,原子只能有2个电子层,最外层电子数为6,故R为O元素;Z的单质为空气的主要成分,原子序数介于碳、氧之间,故Z为N元素;T原子的价层电排布式是3d74s2,则T为Co.
(1)T原子的价层电排布式是3d74s2,则价层电子排布图是: ,
,
故答案为: ;
;
(2)在C2H4分子中,C原子形成3个σ键,没有孤对电子,杂化轨道数目为3,故碳原子杂化轨道类型是sp2杂化,
故答案为:sp2;
(3)同周期自左而右电负性增大,故电负性Y(C)<Z(N),
同周期自左而右原子半径减小,故原子半径Z(N)>R(O),
CH4O为甲醇,分子之间存在氢键,沸点高于C2H6 的,即沸点C2H6<CH4O,
HNO3中非羟氧基数目比HNO2中非羟氧基数目多,故酸性:HNO3>HNO2,
故答案为:
| 电负性 | 原子半径 | 沸点 | 酸性 |
| Y<Z | Z>R | Y2X6<YX4R | XZR3>XZR2 |
点评 本题是对物质结构与性质的考查,涉及核外电子排布、杂化方式、元素周期律、分子结构与性质、结构计算、陌生方程式书写等,是对学生综合能力的考查,需要学生具备扎实的基础.


 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案 蓝天教育暑假优化学习系列答案
蓝天教育暑假优化学习系列答案科目:高中化学 来源: 题型:选择题
| A. | 原子序数:B>A>D>C | B. | 原子半径:A>B>C>D | ||
| C. | 金属性:A>B,非金属性:C>D | D. | 离子半径:D2->C->B2+>A+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 压强Mpa 转化率% 温度/℃ | 0.1 | 0.5 | 1 | 10 |
| 400 | 99.2 | 99.6 | 99.7 | 99.9 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该溶液中H+、NH4+、NO3-、Al3+可以大量共存 | |
| B. | 该溶液中通入足量CO2气体无明显现象 | |
| C. | 用该溶液浸泡锅炉中的水垢,可使硫酸钙转化为碳酸钙 | |
| D. | 与苯酚溶液反应的离子方程式为:2C6H5OH+CO32-→2C6H5O-+H2O+CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由铝土矿冶铝:铝土矿$→_{Na_{3}AlF_{6}}^{电解}$Al | |
| B. | 制硫酸:硫铁矿$→_{空气}^{高温}$SO2$\stackrel{H_{2}O}{→}$H2SO3$\stackrel{O_{2}}{→}$H2SO4 | |
| C. | 由NaCl制漂白粉:NaCl(aq)$\stackrel{电解}{→}$Cl2$\stackrel{石灰乳}{→}$漂白粉 | |
| D. | 合成氨:NH4Cl和Ca(OH)2固体$\stackrel{△}{→}$NH3$\stackrel{碱石灰}{→}$纯净干燥的氨气 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2O在高温下也难分解 | |
| B. | F2、Cl2、Br2、I2单质的熔点依次升高 | |
| C. | SiH4的熔点高于CH4的熔点 | |
| D. | NH3的沸点高于PH3的沸点 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com