
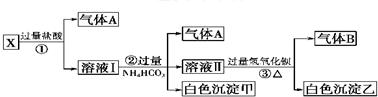
| A、气体A能使湿润的红色石蕊试纸变蓝,气体B能使湿润的蓝色石蕊试纸变红 |
| B、白色沉淀甲是混合物,白色沉淀乙是纯净物 |
| C、Ag+、Ba2+、Al3+、MnO4-、SO42-一定都不存在于溶液中 |
| D、Na+、AlO2-、CO32-一定存在于溶液中 |


科目:高中化学 来源: 题型:
| A、溶液中的Na+总数增大 |
| B、溶液的碱性增强 |
| C、溶质的质量分数不变 |
| D、溶液的质量不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 溶质 | 实验步骤 | 实验现象 | 离子方程式 |
| SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:
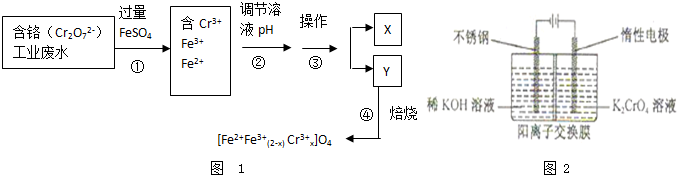
| 样品序号 | 取样深度(m) | 有机质(×10-2g) | 总铬(×10-6g) |
| 样品A-1 | 0.00~0.30 | 2.81 | 114 |
| 样品A-2 | 0.30~0.60 | 1.72 | 111 |
| 样品A-3 | 1.20~1.80 | 1.00 | 88 |
| 样品B-1 | 0.00~0.30 | 2.60 | 116 |
| 样品B-2 | 0.30~0.60 | 2.48 | 112 |
| 样品B-3 | 1.20~1.80 | 1.83 | 106 |
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| 反应时间/min | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
| 压强/MPa | 16.80 | 14.78 | 13.86 | 13.27 | 12.85 | 12.60 | 12.60 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
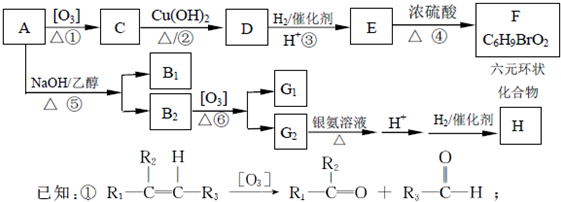
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Fe2O3、Al2O3 |
| B、Fe2O3 |
| C、Fe (OH)2、Al (OH)3 |
| D、Fe (OH)3、Al (OH)3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com