
分析 (1)根据同一周期从左到右元素原子半径逐渐减小以及下一周期元素原子半径比上一周期大;
(2)先根据质量数=质子数+中子数,求出中子数,最后比较大小.
解答 解:(1)因同一周期从左到右元素原子半径逐渐减小,所以半径:2311Na>2412Mg,147N>188O; 下一周期元素原子半径比上一周期大,所以2311Na>2412Mg>147N>188O;
故答案为:②③④①;
(2)188O的质子数为8,中子数为10,
2412Mg的质子数为12,中子数为12,
2311Na的质子数为11,中子数为12,
147N的质子数为7,中子数为7,
所以质子数小于中子数的是188O、2311Na;
故答案为:①②.
点评 本题主要考查了原子半径大小比较、质量数=质子数+中子数,质子数=原子序数等,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 气态氢化物稳定性 H2O<NH3<CH4 | B. | 微粒半径 Al3+<F-<Cl- | ||
| C. | 碱性 Mg(OH)2<NaOH<KOH | D. | 熔点 冰醋酸<食盐<金刚石 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓硝酸保存在棕色的广口瓶中,并放在阴凉处 | |
| B. | 少量的金属钠应保存在煤油中 | |
| C. | 烧碱溶液放在带玻璃塞的磨口试剂瓶中 | |
| D. | 用做感光材料的溴化银贮存在无色试剂瓶中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫离子的核外电子排布式:1s22s22p63s23p6 | |
| B. | N2的结构式::N≡N: | |
| C. | NaCl的电子式: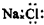 | |
| D. | 原子核内有8个中子的碳原子:${\;}_8^{14}C$ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | ||
| 2 | ① | ② | ③ | ||||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||||
| 4 | ⑨ | ⑩ |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 阴极:2H++2e-=H2↑ 阳极:4OH--4e-=2H2O+O2↑ | |
| B. | 阴极:Cu2++2e-=Cu 阳极:4OH--4e-=2H2O+O2↑ | |
| C. | 阴极:2H++2e-=H2↑ 阳极:2Cl--2e-=Cl2↑ | |
| D. | 阴极:Cu2++2e-=Cu 阳极:2Cl--2e-=Cl2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④ | B. | ①② | C. | ②③ | D. | ②④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com