
| T/℃ | 200 | 300 | 400 |
| K | K1 | K2 | 0.5 |
分析 (1)5min达平衡,△c(NH3)=0.1mol/L,根据v=$\frac{△c}{△t}$计算v(NH3),再根据反应速率之比等于系数之比计算v(N2);利用浓度变化量之比等于化学计量数之比,根据△c(NH3)计算△c(H2),再根据n=cV计算参加反应的氢气的物质的量,据此计算转化率;
(2)反应是气体体积减小的放热反应,平衡后,若要提高H2的转化率,改变条件需要平衡正向进行,但不能增大氢气的量;
(3)①对于放热反应,温度越高,平衡逆向移动,反应平衡常数越小;
②根据平衡状态的判断依据判断,N2(g)+3H2(g)?2NH3(g)△H<0,反应是气体体积减小的放热反应,则
A、反应过程中容器内各物质变化的浓度之比始终等于计量数之比,和起始量变化量有关;
B、不同物质的正逆反应速率之比等于其计量数之比是平衡状态;
C、反应前后气体物质的量变化,当容器内压强不变,气体的物质的量不变;
D、如果是在密闭容器中反应,质量不变,体积不变,密度始终不变;
③化学平衡常数,正反应平衡常数和你反应的平衡常数互为倒数,根据浓度熵和平衡常数的关系来确定平衡的移动方向;
(4)化学反应速率是表示物质反应快慢的物理量,在一定条件下反应达到化学平衡状态时,正逆反应速率相等,各物质的浓度不变,化学平衡为动态平衡,当外界条件发生改变时,平衡发生移动,可通过改变外界条件是平衡发生移动,提高化工生产的综合经济效益.
解答 解:(1)5min达平衡,△c(NH3)=0.1mol/L,所以v(NH3)=$\frac{0.1mol/L}{5min}$=0.02mol/(L•min),根据反应速率之比等于系数之比,则前5分钟的平均反应速率v(N2)=$\frac{1}{2}$×0.02mol/(L•min)=0.01mol•L-1•min-1,
故答案为:0.01mol•L-1•min-1;
(2)A.催化剂不改变平衡移动,无法提高H2的转化率,故A错误;
B.增大容器体积,相当于减小压强,平衡逆反应方向移动,氢气的转化率减小,故B错误;
C.反应为放热反应,降低温度,平衡向正反应移动,氢气的转化率提高,故C正确;
D.加入一定量N2,平衡向正反应方向移动,氢气的转化率提高,故D正确;
故答案为:CD;
(3)①该反应正反应是放热反应,升高温度,平衡向逆反应方向移动,生成物浓度减小,反应物浓度增大,则K1>K2,
故答案为:>;
②N2(g)+3H2(g)?2NH3(g)△H<0,反应是气体体积减小的放热反应,则
A.平衡浓度之比和起始量和变化量有关,容器内各物质的浓度之比等于计量数之比,不能证明正逆反应速率相等,故A错误;
B.不同物质的正逆反应速率之比等于其计量数之比是平衡状态,3υ(N2)(正)=υ(H2)(逆),说明氢气的正逆反应速率相同是平衡状态,故B正确;
C.反应前后气体物质的量变化,当容器内压强不变,气体的物质的量不变,该反应达平衡状态,故C正确;
D.如果是在密闭容器中反应,质量不变,体积不变,密度始终不变,故D错误;
故答案为:BC;
③400℃时,反应2NH3(g)?N2(g)+3H2(g)的化学平衡常数K的值和反应N2(g)+3H2(g)?2NH3(g)的平衡常数呈倒数,所以K=$\frac{1}{0.5}$=2;
当测得NH3、N2和H2 物质的量分别为3mol、2mol和1mol时,此时的浓度商Qc=$\frac{2×{1}^{3}}{{3}^{2}}$=$\frac{2}{9}$<K=2,说明反应正向进行,则v正>v逆,
故答案为:2;>;
(4)A.根据影响化学反应速率的因素,可指导怎样在一定时间内快出产品,故A正确;
B.结合影响化学平衡的因素,采用合适的外界条件,是平衡向正反应方向移动,可提高产率,故B正确;
C.催化剂影响反应速率,但不影响化学平衡,则无法提高产品产率,故C错误;
D.在一定的反应速率的前提下,尽可能使平衡向正反应方向移动,可提高化工生产的综合经济效益,故D正确;
故答案为:C.
点评 本题考查了化学平衡的计算,题目难度中等,涉及化学平衡常数、化学反应速率、转化率的计算、化学平衡状态的判断等知识,明确化学平衡及其影响为解答关键,试题有利于提高学生的分析、理解能力及化学计算能力.


科目:高中化学 来源: 题型:选择题
| ① | ② | ③ | ④ | |
| 氨水 | 氢氧化钠 | 醋酸 | 盐酸 | |
| pH | 11 | 11 | 3 | 3 |
| A. | 分别加水稀释10倍,四种溶液的pH为:①>②>③>④ | |
| B. | 温度上升10℃,四种溶液的pH不变 | |
| C. | ③④中分别加入适量的氯化按晶体后,③的pH减小,④的pH不变 | |
| D. | 将①④两种溶液等体积混合,所得溶液中c (C1-)>c NH4+)>c (H+)>c (OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:1 | B. | 1:3 | C. | 2:3 | D. | 4:9 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分液、萃取、蒸馏 | B. | 萃取、蒸馏、分液 | C. | 分液、蒸馏、萃取 | D. | 蒸馏、萃取、分液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
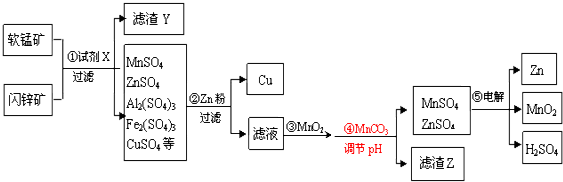
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学键 | H-H | C-O | C≡C | H-O | C-H |
| E/(KJ.mol-1) | 436 | 343 | x | 465 | 413 |
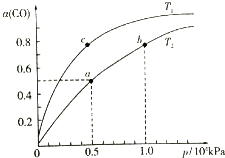
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | MnO2 | B. | FeCl2 | C. | 稀盐酸 | D. | NaHCO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 24 | B. | 42 | C. | 66 | D. | 108 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com