
向CuSO4溶液中逐滴加入过量KI溶液,观察到产生白色沉淀,溶液变为棕色。淀粉KI溶液中通入SO2气体,溶液无明显变化。则下列分析中正确的是
| A.白色沉淀是CuI2,棕色溶液含有I2 |
| B.滴加KI溶液时,转移2mol e- 时生成1mol白色沉淀 |
| C.通入SO2时,SO2与I—反应,I—作还原剂 |
| D.上述实验条件下,物质的氧化性:Cu2+>I2>SO2 |
D
解析试题分析:CuSO4溶液中逐滴加入KI溶液化学方程式为2CuSO4+4KI═2K2SO4+2CuI↓+I2,向反应后的混合物中不断通入SO2气体,反应方程式:SO2+2H2O+I2=H2SO4+2HI,则A、由上述分析及化学方程可知,白色沉淀是CuI,溶液中含有I2,故A错误;B、CuSO4溶液中逐滴加入KI溶液化学方程式为2CuSO4+4KI═2K2SO4+2CuI↓+I2,由方程式可知每转移2mol电子生成2molCuI,所以转移1mole-时生成1molCuI白色沉淀,故B错误;C、反应后的混合物中不断通入SO2气体,反应方程式:SO2+2H2O+I2=H2SO4+2HI,由反应可知,碘元素化合价由0价降低为-1价,被还原,所以I2是氧化剂,二氧化硫是还原剂,故C错误;D、2CuSO4+4KI═2K2SO4+2CuI↓+I2反应中Cu2+化合价降低是氧化剂,I2是氧化产物,氧化剂的氧化性强于氧化产物的氧化性,所以物质的氧化性:Cu2+>I2,SO2+2H2O+I2=H2SO4+2HI中碘元素化合价由0价降低为-1价,I2是氧化剂,SO2被氧化,所以物质氧化性I2>SO2,所以氧化性Cu2+>I2>SO2,故D正确,故选:D。
考点:考查氧化还原反应的应用与有关计算和判断


科目:高中化学 来源: 题型:填空题
有一包白色固体,可能含有CaCO3、Na2SO4、KNO3、CuSO4、BaCl2五种物质中的一种或几种。现进行以下实验:
①取少量白色固体加到足量的水中,得到白色沉淀,上层清液为无色。
②向上述悬浊液中加入足量的稀硝酸,白色沉淀消失,并有气泡产生。
③取少量②的溶液滴入硝酸钡溶液,有白色沉淀生成,再加入稀硝酸,白色沉淀不消失。
根据上述实验现象判断:白色固体中一定含有 ,
一定不含有 , 可能会有 ;
上述实验中有关反应的离子方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
铬及其化合物常被应用于冶金、化工、电镀、制药、纺织等行业,但使用后的废水因其中含高价铬的化合物而毒性很强。工业上往往采取下列循环工艺防止铬的污染: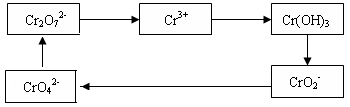
完成下列填空:
(1)含Cr2O72-离子的废水在酸性条件下用Fe3O4处理,反应的离子方程式如下:
Cr2O72- + Fe3O4 + H+ → Cr3+ + Fe3+ + H2O
配平上述离子反应方程式,并标出反应中电子转移的方向和数目。
(2)向上述反应后的溶液中加入碱溶液,让废水的pH升至8~10,控制适当的温度,使产物中的金属阳离子全部转变为沉淀。写出从该沉淀中分离出Cr(OH)3的离子方程式 、
。
(3)回收所得的Cr(OH)3,经处理后又可转变成K2Cr2O7。纯净的K2Cr2O7常用于准确测定Na2S2O3溶液的物质的量浓度,方法如下:
① Cr2O72- +6I- + 14H+ →3I2 + 2Cr3+ + 7H2O ② 2S2O32- + I2→S4O62- + 2I-
准确称取纯净的K2Cr2O7 0.1225g ,配成溶液,用Na2S2O3溶液滴定,消耗Na2S2O3溶液25.00mL。则Na2S2O3溶液的物质的量浓度为 (保留四位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
某结晶水合物含有两种阳离子和一种阴离子。称取两份质量均为45.3 g的该结晶水合物,分别制成溶液。向其中一份逐滴加入NaOH溶液,开始发现溶液中出现白色沉淀并逐渐增多;一段时间后有气体逸出,该气体有刺激性气味,能使湿润的红色石蕊试纸变蓝,加热后共计可收集到2.24 L该气体(标准状况);最后白色沉淀逐渐减少并最终消失。
另一份逐滴加入Ba(OH)2溶液,开始现象类似,但最终仍有白色沉淀;过滤,用稀硝酸处理沉淀物,经洗涤和干燥,得到白色固体46.6 g。
请回答以下问题:
(1)试通过计算确定该结晶水合物的化学式为 ;
(2)假设过程中向该溶液中加入的Ba(OH)2溶液的物质的量浓度为2.0 mol·L-1。
①加入少量Ba(OH)2溶液,则反应的离子方程式为 ;
②加入一定量的Ba(OH)2溶液后,若所得沉淀的总物质的量最大,则反应的离子方程式为 ;
③若加入75 mL的Ba(OH)2溶液,则得到的沉淀质量为 。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
(15分)废旧碱性锌锰干电池内部的黑色物质A主要含有MnO2、NH4Cl、ZnCl2,还有少量的FeCl2和炭粉,用A制备高纯MnCO3的流程图如下。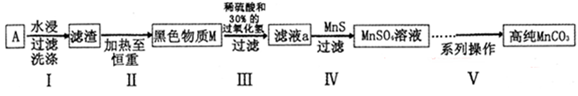
(1)碱性锌锰干电池的负极材料是 (填化学式)。
(2) 第I步操作得滤渣的成分是 ;第Ⅱ步操作的目的是 。
(3)步骤Ⅲ中制得MnSO4,该反应的化学方程式为 。
(4)第Ⅳ步操作是对滤液a进行深度除杂,除去Zn2+的离子方程式为 。
(已知:Ksp(MnS)=2.5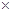 10-13,Ksp(ZnS)=1.6
10-13,Ksp(ZnS)=1.6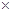 10-24)
10-24)
(5)已知:MnCO3难溶于水和乙醇,潮湿时易被空气氧化,l00oC时开始分解;Mn(OH)2开始沉淀时pH为7.7。
第V步系列操作可按以下步骤进行:
操作l:加入试剂X,控制pH<7.7; 操作2:过滤,用少量水洗涤2~3次;
操作3:检测滤液; 操作4:用少量无水乙醇洗涤2~3次;
操作5:低温烘干。
①试剂X是 ;
②操作3中,说明SO42-已除干净的方法是 。
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
铁溶于一定浓度的硝酸时,发生反应的离子方程式为:
aFe+bNO3-+cH+═dFe2++fFe3++gNO↑+hNO2↑+kH20,下列有关推断中,不正确的是( )
| A.2d+3f=3g+h |
| B.c+b=2d+3f |
| C.HNO3的氧化性强于Fe3+ |
| D.反应中每消耗5.6gFe,转移0.2mol~0.3mole- |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
将一定量的氯气通入30 mL浓度为10.00 mol/L的氢氧化钠浓溶液中,加热少许时间后溶液中形成NaCl、NaClO、NaClO3共存体系。下列判断不正确的是
| A.与NaOH反应的氯气一定为0.15 mol |
| B.n(Na+)∶n(Cl-) 可能为7∶3 |
| C.若反应中转移的电子为n mol,则n一定大于0.15 mol |
| D.n(NaCl)∶n(NaClO)∶n(NaClO3)可能为7∶2∶1 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
在2009年10月1日,新的饮用矿泉水强制性国家标准《饮用天然矿泉水》正式实施,其中“溴酸盐(BrO3-)”这一潜在致癌物质被做了严格限制。有关专家解释,矿泉水在开采过程中会含有少量溴化物(Br-),在后续的生产过程中经臭氧(O3)处理逐渐转化成溴酸盐。下列有关该转化过程的认识正确的是( )
| A.该过程中溴化物(Br-)得到电子 |
| B.该过程中臭氧(O3)是氧化剂,溴酸盐(BrO3-)是还原剂 |
| C.该过程中溴元素被还原,氧元素被氧化 |
| D.该过程中溴元素发生氧化反应,氧元素发生还原反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com