
【题目】钒和镍及其化合物是重要的合金材料和催化剂,其储氢合金可作为一种新型锌离子电池的负极材料,该电池以Zn(CF3SO3)2为电解质,以有缺陷的阳离子型ZnMn2O4为电极,成功获得了稳定的大功率电流。
(1)基态钒原子的价电子排布式为_______,其排布时能量最高的电子所占据能级的原子轨道有_______个伸展方向。
(2)VO2+与 可形成配合物。
可形成配合物。 中,三种非金属元素的电负性由大到小的顺序为_______ (用元素符号表示)。
中,三种非金属元素的电负性由大到小的顺序为_______ (用元素符号表示)。
(3)镍形成的配离子[Ni(NH3)6]2+、[Ni(CN)4]2-中,NH3分子的空间构型为_______。与CN-互为等电子体的一种分子的化学式为________ 。
(4)三氟甲磺酸(CF3SO3H)是一种有机强酸,结构式如图1所示,通常以CS2、IF5、H2O2等为主要原料来制取。
①H2O2分子中O原子的杂化方式为_______。
②三氟甲磺酸能与碘苯反应生成三氟甲磺酸苯酯和碘化氢。1个三氟甲磺酸苯酯分子中含有σ键的数目为_______。
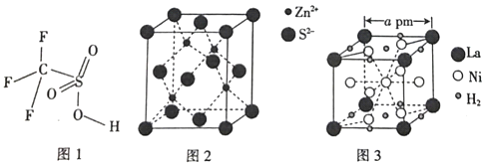
(5)硫化锌晶体的构型有多种,其中一种硫化锌的晶胞如图2所示,该晶胞中S2-的配位数为_________。
(6)镧镍合金是重要的储氢材料,其储氢后的晶胞如图3所示。
①储氢前该镧镍合金的化学式为_________。
②该镧镍合金储氢后氢的密度为_________(用NA表示阿伏加德罗常数的数值)g/cm3。
【答案】 3d34s2 5 O>C>H 三角锥形 N2(或CO) sp3 19 4 LaNi5 ![]()
【解析】(1)钒为23号元素,基态钒原子的价电子排布式为3d34s2,其排布时能量最高的电子所占据能级为3d,3d原子轨道有5个伸展方向,故答案为:3d34s2;5;
(2)C、H、O的非金属性O>C>H,电负性O>C>H,故答案为:O>C>H;
(3)NH3分子中N原子的价层电子对数目=3+![]() ×(5-1×3)=4,采用sp3杂化,空间构型为三角锥形;与CN-互为等电子体的一种分子为N2(或CO),故答案为:三角锥形;N2(或CO);
×(5-1×3)=4,采用sp3杂化,空间构型为三角锥形;与CN-互为等电子体的一种分子为N2(或CO),故答案为:三角锥形;N2(或CO);
(4)①H2O2分子中O原子与2个原子相连,含有2个孤电子对,价层电子对数目=2+2=4,采用sp3杂化,故答案为:sp3;
②根据三氟甲磺酸的结构,三氟甲磺酸苯酯的结构为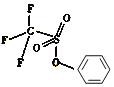 ,1个三氟甲磺酸苯酯分子中含有σ键有3个C-F键、1个C-S键、2个S=O键、1个S-O键、1个C-O键,苯环上含有5个C-H和6个C-C键,σ键数目为19个,故答案为:19;
,1个三氟甲磺酸苯酯分子中含有σ键有3个C-F键、1个C-S键、2个S=O键、1个S-O键、1个C-O键,苯环上含有5个C-H和6个C-C键,σ键数目为19个,故答案为:19;
(5)根据硫化锌的晶胞结构图,该晶胞中S2-和Zn2+配位数相等,晶体中与Zn2+距离最近且相等的S2-有4个,配位数为4,故答案为:4;
(6)①根据晶胞结构图,储氢前,晶胞中含有镧原子数=8×![]() =1,镍原子数=8×
=1,镍原子数=8×![]() +1=5,合金的化学式为LaNi5,故答案为:LaNi5;
+1=5,合金的化学式为LaNi5,故答案为:LaNi5;
②晶胞中H2数目为8×![]() +2×
+2×![]() =3,储氢后合金的化学式为LaNi5H6,储氢后1mol晶胞的体积为(a×10-10cm)3×NA= a3×10-30×NA cm3,1mol晶胞中含有的氢气质量为6g,则该镧镍合金储氢后氢的密度为
=3,储氢后合金的化学式为LaNi5H6,储氢后1mol晶胞的体积为(a×10-10cm)3×NA= a3×10-30×NA cm3,1mol晶胞中含有的氢气质量为6g,则该镧镍合金储氢后氢的密度为![]() =
=![]() g/cm3,故答案为:
g/cm3,故答案为: ![]() 。
。


 轻松暑假总复习系列答案
轻松暑假总复习系列答案科目:高中化学 来源: 题型:
【题目】某反应的△H=+100kJmol﹣1 , 下列有关该反应的叙述正确的是( )
A.正反应活化能小于100 kJmol﹣1
B.逆反应活化能一定小于100 kJmol﹣1
C.正反应活化能不小于100 kJmol﹣1
D.正反应活化能比逆反应活化能小100 kJmol﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】写出下列有机反应的化学方程式
(1)由苯乙烯 ![]() 制取 聚苯乙烯
制取 聚苯乙烯
(2)丙烯与溴化氢按照马氏规则发生加成反应
(3)甲苯与氯气在光照的条件下发生取代反应(仅写一元取代)
(4)乙烯使溴水褪色 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钌(Ru)是一种硬而脆呈浅灰色的多价稀有金属,性质很稳定,且耐腐蚀性很强。实验室用H2还原RuO2来制备金属钌的装置如图所示。下列说法不正确的是
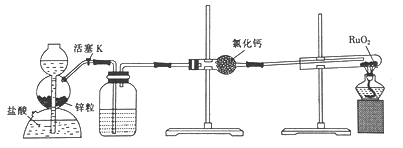
A. 加热试管前,应先收集气体并点燃,通过爆鸣声判断气体的纯度
B. 洗气瓶中盛装的可能是NaOH溶液,用于除去HCl
C. 结束反应时,先停止加热,再关闭活塞K
D. 启普发生器也可用于二氧化锰与浓盐酸反应制备氯气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质A、B、C、D、E、F、G、H、I、J、K有下图转化关系,D、E为气体单质,其中D为最轻的气体。试回答:

(1)写出物质K的化学式 _______________;
(2)写出A与NaOH溶液反应的化学方程式:______________________________________;
(3)写出反应“I→J”的离子方程式:____________________________________________;
(4)在溶液I中滴入NaOH溶液,可观察到的现象是:_______________________________;
(5)向1 L 0.2mol/L的C溶液中加入a ml 5mol/L的NaOH溶液得到了7.8g沉淀,求a=____mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上采用软锰矿(主要成分为MnO2)来制取硫酸锰,工艺流程如下:
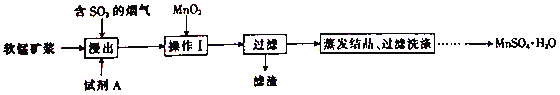
已知:浸出液中的金属离子主要是Mn2+,还含有少量的Fe2+。回答下列问题:
(1)实验室进行过滤操作时用到的玻璃仪器有玻璃棒、烧杯和______。
(2)浸出后,锰主要以Mn2+的形式存在,写出MnO2与SO2反应的离子方程式:____________。
(3)浸出过程的副反应之一是部分SO2被氧化为硫酸,致使浸出液的pH下降,这将不利于软锰矿浆继续吸收SO2。欲消除生成的硫酸,可选用的试剂A是______(填字母)。
A.MnCO3 B.MnO2 C.Mn(OH)2 D.MnSO4
(4)操作I的目的是__________和调节溶液的pH至3~4。检验过滤后的滤液中是否含有Fe3+的操作是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于电解质溶液的叙述正确的是( )
A.常温下,在pH=7的醋酸钠和醋酸混合溶液中:c(CH3COO﹣)>c(Na+)
B.稀释醋酸溶液,溶液中所有离子的浓度均降低
C.在pH=5的氯化钠和稀硝酸的混合溶液中,c(Na+)=c(Cl﹣)
D.0.1molL﹣1的硫化钠溶液中,c(OH﹣)=c(H+)+c(HS﹣)+c(H2S)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】配制一定物质的量浓度的KOH溶液时,造成最终浓度偏低的原因可能是( )
A.容量瓶事先未烘干
B.定容时俯视观察液面
C.未用蒸馏水洗涤烧杯
D.定容后,摇匀时有少量液体流出
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com