
体积比为1:1:1的氯化钠、氯化镁和氯化铝溶液,分别加入等体积、等浓度的硝酸银溶液,均恰好完全反应生成氯化银沉淀,则这三种溶液的物质的量浓度比为 ( )
A.1:1:1 B.1:2:3 C.3:2:1 D.6:3:2
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:阅读理解
查看答案和解析>>
科目:高中化学 来源:2010年江苏省江都中学高一第二学期期末考试化学试题 题型:填空题
(10分)CO2、SO2、NOx是对环境影响较大的气体,控制和治理CO2、SO2、NOx是解决温室效应、减少酸雨和光化学烟雾的有效途径。

(1)有效“减碳”的手段之一是节能。下列制氢方法最节能的是 ▲ 。(填字母序号)
A.电解水制氢:2H2O 2H2↑+O2↑
2H2↑+O2↑
B.高温使水分解制氢:2H2O 2H2↑+O2↑
2H2↑+O2↑
C.太阳光催化分解水制氢:2H2O 2H2↑+O2↑
2H2↑+O2↑
D.天然气制氢:CH4+H2O CO+3H2
CO+3H2
(2)CO2可转化成有机物实现碳循环。在体积为1 L的密闭容器中,充入1 molCO2和3 mol H2,一定条件下发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH="-49.0" kJ/mol,测得CO2 和CH3OH(g)的浓度随时间变化如上图所示。
CH3OH(g)+H2O(g) ΔH="-49.0" kJ/mol,测得CO2 和CH3OH(g)的浓度随时间变化如上图所示。
①从3 min到10 min,v(H2)= ▲ mol/(L·min)-1。
②能说明上述反应达到平衡状态的是 ▲ (选填编号)。
A.反应中CO2与CH3OH的物质的量浓度之比为1︰1(即图中交叉点)
B.混合气体的密度不随时间的变化而变化
C.单位时间内每消耗3 mol H2,同时生成1 mol H2O
D.CO2的体积分数在混合气体中保持不变
(3)新型氨法烟气脱硫技术的化学原理是采用氨水吸收烟气中的SO2,再用一定量的磷酸与上述吸收产物反应。该技术的优点除了能回收利用SO2外,还能得到一种复合肥料,该复合肥料可能的化学式为 ▲ (只要求写一种)。
(4)在汽车上安装三效催化转化器,可使汽车尾气中的主要污染物(CO、NOx、碳氢化合物)进行相互反应,生成无毒物质,减少汽车尾气污染。某研究性学习小组探究某种催化剂在不同空燃比(空气与燃油气的质量比)条件下对汽车尾气的催化效果。在一定条件下,测得尾气中的主要污染物的转化率与空燃比的关系如右图所示。空燃比约为 ▲ 时,催化剂对汽车尾气的催化效果最好。(填a、b、c、d)
查看答案和解析>>
科目:高中化学 来源:2013-2014学年安徽省高三上学期期中考试化学试卷(解析版) 题型:选择题
以下有关物质的质量分数和物质的量浓度的叙述正确的是
A.等体积硫酸铁、硫酸铜、硫酸钾溶液分别与足量的氯化钡溶液反应,若生成硫酸钡沉淀的质量相等,则三种硫酸盐溶液的物质的量浓度之比为1:1:1
B.Na2O2和Na2O各0.1mol分别放入100g水中,所得溶液的物质的量浓度不相等
C.质量分数分别为5%和15%的氨水等体积混合后所得溶液的质量分数为10%
D.20℃时,饱和KCl溶液的密度为1.174g•cm-3,物质的量浓度为4.0 mol•L-1,则此溶液中KCl的质量分数为 ×100%
×100%
查看答案和解析>>
科目:高中化学 来源:2010-2011学年河南省许昌新乡平顶山高三第三次调研考试(理综)化学部分 题型:填空题
已知:A、B、C、D、E、F是周期表中前36号元素,A是原子半径最小的元素,B元素基态原子的2P轨道上只有两个电子,C元素的基态原子L层只有2对成对电子,D是元素周期表中电负性最大的元素,E2+的核外电子排布和Ar原子相同,F的核电荷数是D和E的核电荷数之和。
请回答下列问题:
(1)分子式为BC2的空间构型为__ __;F2+的核外电子排布式为 。
(2)A分别与B、C形成的最简单化合物的稳定性B____C(填“大于”或“小于”);A、C两元素可组成原子个数比为1:1的化合物,C元素的杂化类型为 。
(3)A2C所形成的晶体类型为_ ___;F单质形成的晶体类型为 ,其采用的堆积方式为 。
(4)F元素氧化物的熔点比其硫化物的____(填“高”或 “低”),请解释其原因____。
(5)D跟E可形成离子化合物,其晶胞结构如右图。该离子化合物晶体的密度为pg.cm。3,则晶胞的体积是 。(用含p的代数式表示)。
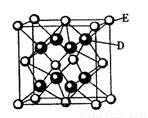
查看答案和解析>>
科目:高中化学 来源: 题型:
(08长沙雅礼中学一模)(16分)短周期中的A、B、C、D、E 5种元素,原子序数逐渐增大,A、D同主族;A、B的原子序数之和等于C的原子序数;C2-离子与D+离子的核外电子数相等;B原子与D+离子核外电子数之和等于E原子的核外电子数,且D、E两元素能形成微粒个数比为1∶1的离子化合物.
(1)C的元素名称为_______。
(2)A、B元素形成化合物B2A4,其电子式为 。B2A4一空气燃料电池是一种碱性燃料电池,电解质溶液是20%一30%的KOH 溶液,放电时生成B2和水,则该燃料电池放电时,负极的电极反应式是_____。
(3)常温下用石墨为电极电解含0.2mol DE的水溶液时,阳极的电极反应式为__________,阳极产生0.2mol气体时,测得此时溶液的体积为200mL,则该溶液的pH最接近的数值为 。
(4)A、B、C、D、E中的任意三种元素可组成多种化合物,X和Y是其中的两种,X和Y都是既含离子键又含共价键的离子化合物;将X、Y分别溶于水时,X能促进水的电离,而Y能抑制水的电离,X水溶液的pH<7,Y水溶液的pH>7.将0.2mol?L-1的X溶液与0.1mol?L-1的Y溶液等体积混合后,溶液呈碱性.请判断:
①X的化学式为__________,Y的化学式为_________ 。
②混合溶液中各种带电粒子的物质的量浓度由大到小的顺序为_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com