
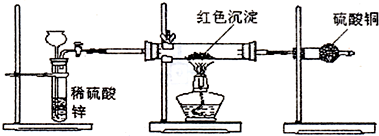
Cu2O呈红色,在酸性条件下会发生自身氧化还原反应。用H2还原CuO所得产物呈红色,若要检验其中是否含有Cu2O,以下试剂选择和判断方法均正确的是:
选项 试剂 判断方法
A 稀硝酸 是否生成蓝色溶液
B 稀硫酸 固体物质是否完全溶解
C 浓硫酸 是否有无色气体生成
D 稀盐酸 是否生成蓝色溶液
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:阅读理解

| 9(b-a) |
| a |
| 900(b-a) |
| a |
| 9(b-a) |
| a |
| 900(b-a) |
| a |
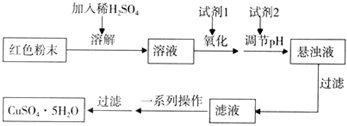
| 物质 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
| 开始沉淀pH | 6.0 | 7.5 | 1.4 |
| 沉淀完全pH | 13 | 14 | 3.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 9(b-a) |
| a |
| 9(b-a) |
| a |
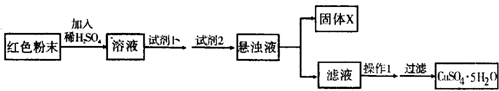
| 物质 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
| 开始沉淀pH | 6.0 | 7.5 | 1.4 |
| 沉淀完全pH | 13 | 14 | 3.7 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com