
| A. | BaSO4粉末可用作钡餐,是因为BaSO4为非电解质 | |
| B. | 有机物苯、乙醇、蔗糖都属于非电解质 | |
| C. | 强电解质溶液的导电能力一定比弱电解质溶液的导电能力强 | |
| D. | 固态共价化合物不导电,熔融态的共价化合物都可以导电 |
分析 A.硫酸钡为强电解质,硫酸钡粉末难溶于水,可用作钡餐;
B.在水溶液和熔融状态下都不导电的化合物为非电解质;
C.溶液导电能力与离子浓度大小有关;
D.熔融状态下共价化合物不发生电离.
解答 解:A.BaSO4粉末可用作钡餐,是因为BaSO4难溶于水,故A错误;
B.苯、乙醇、蔗糖在水溶液和熔融状态下都不导电,它们属于非电解质,故B正确;
C.离子浓度大小影响溶液导电性,强电解质溶液中离子浓度不一定等于弱电解质,则其导电能力不一定比弱电解质溶液的导电能力强,故C错误;
D.固态共价化合物和熔融态的共价化合物都不发生电离,则两种状态下的共价化合物都不导电,故D错误;
故选B.
点评 本题考查了电解质与非电解质、电解质与溶液导电性的判断,题目难度不大,明确影响溶液导电性的因素为解答关键,注意掌握电解质与弱电解质、强电解质与弱电解质的区别.


科目:高中化学 来源: 题型:解答题
| 温度/K | 反应I | 反应Ⅱ | 已知: K1>K2>K1′>K2′ |
| 298 | K1 | K2 | |
| 328 | K1′ | K2′ |

查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 托盘天平 | B. | 胶头滴管 | C. | 250 mL容量瓶 | D. | 量筒 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在标准状况下,1mol水的体积是22.4L | |
| B. | 1molH2所占的体积一定是22.4L | |
| C. | 在标准状况下,NA个任何分子所占的体积约为22.4L | |
| D. | 在标准状况下,质量为28g的CO气体,其体积约为22.4L |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
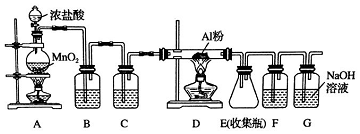
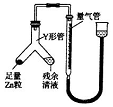
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol任何气体的体积都约是22.4L | |
| B. | lmolH2和O2的混合气体,在标准状况下的体积约为22.4L | |
| C. | lmol H2气态物质,当体积为22.4L时,该气体一定处于标准状况 | |
| D. | 标准状况下,2molH2O体积约为44.8L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com