
| A. | ①③ | B. | ③④ | C. | ①② | D. | ①③④ |
分析 硝酸、硫酸的浓度不同,性质不同,与金属发生反应时,发生不同的氧化还原反应,以此解答该题.
解答 解:①Cu与HNO3溶液中,若为浓硝酸,发生Cu+4HNO3═Cu(NO3)2+2NO2↑+2H2O,若为稀硝酸,则发生3Cu+8HNO3═3Cu(NO3)2+2NO↑+4H2O,故正确;
②Cu与FeCl3溶液中,无论浓度大小都只发生Cu+2FeCl3═2FeCl2+CuCl2,故错误;
③Zn与H2SO4溶液中,若为稀硫酸,发生Zn+H2SO4═ZnSO4+H2↑,若为浓硫酸,则发生Zn+2H2SO4(浓)$\frac{\underline{\;加热\;}}{\;}$ZnSO4+SO2↑+2H2O,故正确;
④Fe与HCl溶液中,无论浓度大小都只发生Fe+2HCl=FeCl2+H2↑,故错误.
故选A.
点评 本题考查常见物质的性质,明确浓稀硝酸、浓硫酸具有强氧化性及发生的化学反应是解答本题的关键,注意相关方程式的书写,难度中等.


 提分百分百检测卷单元期末测试卷系列答案
提分百分百检测卷单元期末测试卷系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 与同族硅元素类似,锗、锡、铅都可用做半导体材料 | |
| B. | 锗与盐酸可能不反应,锡、铅能与盐酸反应 | |
| C. | 锗、锡、铅的+4价氢氧化物的碱性由弱到强的顺序为:Ge(OH)4<Sn(OH)4<Pb(OH)4 | |
| D. | 锗、锡、铅的金属性依次减弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cu是氧化剂 | B. | H2SO4在反应中只表现氧化性 | ||
| C. | Cu在反应中被氧化 | D. | 1mol氧化剂在反应中得到1mol电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5min内用B表示的反应速率为0.018mol/(L•min) | |
| B. | 在该温度下反应的平衡常数为900 | |
| C. | A和B的平衡转化率都为90% | |
| D. | 如果加压,平衡正向移动,可使△H 减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

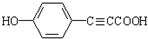
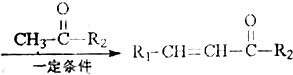 +H2O
+H2O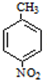 ;反应②的反应类型取代反应.
;反应②的反应类型取代反应.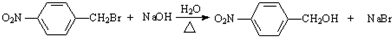 .
.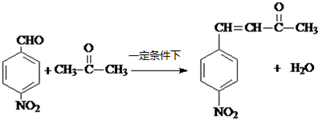 .
. .
.查看答案和解析>>
科目:高中化学 来源:2017届江苏省如皋市高三上学期质量调研一化学试卷(解析版) 题型:选择题
下列指定反应的离子方程式正确的是
A.用醋酸溶解大理石:CaCO3+2H+=Ca2++H2O+CO2↑
B.向氯化铝溶液中滴加过量氨水:Al3++4NH3·H2O=AlO-2+4NH+ 4+2H2O
C.向碳酸氢钙溶液中加入少量烧碱溶液:
Ca2++2HCO-3+2OH-=CaCO3↓+CO2-3+H2O
D.亚硫酸钠溶液中滴加酸性高锰酸钾溶液:
5SO2-3+6H++2MnO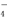 =5SO2-4+2Mn2+ +3H2O
=5SO2-4+2Mn2+ +3H2O
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
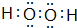 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com