
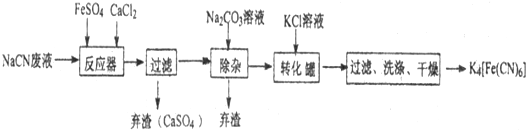
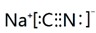 ,NaCN水解呈碱性,为抑制水解,在配制溶液时可将其溶解在氢氧化钠溶液中,在加水稀释,
,NaCN水解呈碱性,为抑制水解,在配制溶液时可将其溶解在氢氧化钠溶液中,在加水稀释, ;NaOH;
;NaOH;

 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、Na+、Fe2+、SO42-、K+ |
| B、HCO3-、K+、NO3-、SO42- |
| C、SO42-、Cl-、CO32-、Na+ |
| D、NH4+、Cl-、Na+、Ba2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
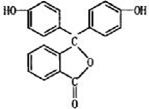 据测定,指示剂酚酞的结构简式可表示为则
据测定,指示剂酚酞的结构简式可表示为则查看答案和解析>>
科目:高中化学 来源: 题型:
| 物质 | X | Y | Z |
| 初始浓度/mol?L-1 | 0.1 | 0.15 | 0 |
| 平衡浓度/mol?L-1 | 0.01 | 0.105 | 0.09 |
查看答案和解析>>
科目:高中化学 来源: 题型:
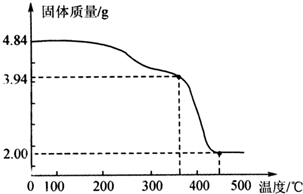
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
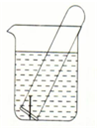 (1)P4(白磷,s)+5O2(g)═P4O10(s)△H=-2983.2kJ/mol
(1)P4(白磷,s)+5O2(g)═P4O10(s)△H=-2983.2kJ/mol| 5 |
| 4 |
| 1 |
| 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、15mol 25% |
| B、20mol 50% |
| C、20mol 75% |
| D、40mol 80% |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com