
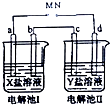
 下图所示的电解池Ⅰ和Ⅱ溶液体积均为100mL,a、b和d均为Pt电极.电解过程中,电极b和d质量均增大.
下图所示的电解池Ⅰ和Ⅱ溶液体积均为100mL,a、b和d均为Pt电极.电解过程中,电极b和d质量均增大.分析 (1)a、b和d均为Pt电极,则在电解过程中不参加反应,由于电极b和d质量均增大,说明这是溶液中的金属离子发生还原反应,在阴极析出金属单质导致,在电解池中与阴极相连的是电源的负极,从而得出M是电源的正极;
(2)根据装置可分析,电极a为阳极,b为阴极,c为阳极,d为阴极,结合电解原理,分析溶液中离子放电顺序,判断电极反应以及计算溶液中氢离子的浓度;
(3)铜的精炼时,让粗铜做阳极,发生氧化反应,产生铜离子、二价铁离子等,电解质溶液是含铜离子的溶液,在阴极铜离子得电子发生还原反应得到精铜.
解答 解:(1)a、b和d均为Pt电极,则在电解过程中不参加反应,由于电极b和d质量均增大,说明这是溶液中的金属离子发生还原反应,在阴极析出金属单质导致,在电解池中与阴极相连的是电源的负极,从而得出M是电源的正极,
故答案为:正;
(2)与电源正极相连的是电解池的阳极,与电源负极相连的是电解池的阴极,所以电极a为阳极,b为阴极,c为阳极,d为阴极,若X是AgNO3,则溶液中有这些离子:Ag+、H+、OH-、NO3-,在阳极OH-比NO3-先放电,电极反应式为:4OH--4e-=2H2O+O2↑,
b极增重是因为在阴极银离子先放电,得电子产生银单质,电极反应为:Ag++e-=Ag,银的质量为0.108g,则物质的量为0.001mol,根据总反应式:4Ag++2H2O$\frac{\underline{\;通电\;}}{\;}$4Ag+O2↑+4H+,
4Ag~4H+,可知b极增重0.108g时,氢离子产生0.001mol,所以氢离子的浓度c(H+)=$\frac{n({H}^{+})}{V}$=$\frac{0.001mol}{0.1L}$=0.01mol•L-1,则溶液的PH=-lgc(H+)=2,
故答案为:4OH--4e-=2H2O+O2↑; 2;
(3)铜的精炼时,让粗铜做阳极,发生氧化反应,产生铜离子、二价铁离子等,所以电极c的材料是粗铜,电解质溶液是含铜离子的溶液,在阴极(d极)铜离子得电子发生还原反应得到精铜,d极电极方程式为:Cu2++2e-=Cu,
故答案为:粗铜; Cu2++2e-=Cu.
点评 本题考查了电解原理的分析应用,主要是电极反应,溶液中离子放电顺序的判断,电极反应书写方法和PH值的计算,掌握基础是关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 正丁烷与异丁烷 | B. | 白磷和红磷 | ||
| C. | ${\;}_{1}^{1}$H2和${\;}_{1}^{2}$H2 | D. | H2O与H2O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应容器中压强不再变化 | |
| B. | X的分解速率与X的生成速率相等 | |
| C. | X、Y、Z的浓度之比为2:1:1 | |
| D. | 单位时间内生成1molY的同时生成1molZ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3CH2OH+CH3COOH$→_{△}^{浓硫酸}$CH3COOHCH2CH3+H2O | |
| B. | 2CH3CH2OH$→_{140℃}^{浓硫酸}$CH3CH2OCH2CH3+H2O | |
| C. | CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O | |
| D. | CH3CH2OH+HBr→CH3CH2Br+H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com