
滴入高锰酸钾溶液的次序(每滴溶液的体积相同) | 高锰酸钾溶液紫色褪去的时间 |
| 先滴入第1滴 | 1min |
| 褪色后再滴入第2滴 | 15s |
| 褪色后再滴入第3滴 | 3s |
| 褪色后再滴入第4滴 | 1s |
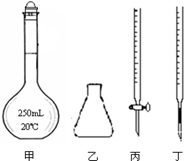


科目:高中化学 来源:不详 题型:单选题
| 编号 | 实验 | 操作 |
| A | 钠与水的反应 | 用镊子从煤油中取出金属钠,切下绿豆大小,放入装满水的烧杯中 |
| B | 配制一定浓度的氯化钾溶液500 mL | 准确称取氯化钾固体,放入到500 mL的容量瓶中,加水溶解、振荡、定容、摇匀 |
| C | 闻氯气法的方法 | 用手轻轻地在瓶口扇动,使极少量氯气飘进鼻孔 |
| D | 分离出分液漏斗中所需的上层液体 | 下层液体从分液漏斗下端管口放出,关闭活塞,换一个烧杯,上层液体继续从分液漏斗下端管口放出 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.①②④⑤⑥ | B.②④⑤ | C.①③⑥ | D.④⑥ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
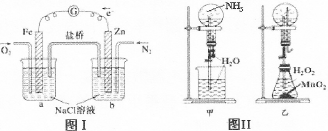
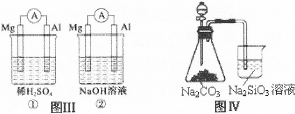
| A.图I装置中通入N2和O2的作用是相同的 |
| B.图Ⅱ中甲、乙两装置产生喷泉的原理一样 |
| C.图Ⅲ①装置中镁片是原电池的负极;②装置中镁片是原电池的正极 |
| D.图Ⅳ分液漏斗盛硝酸能证明非金属性N>C>Si,盛硫酸能证明非金属性S>C>Si |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.①② | B.②④ | C.①③ | D.①②④ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.中和热测定实验中,用铜制环形搅拌器代替环形玻璃搅拌棒,所测中和热的数值 |
| B.中和滴定测定盐酸溶液浓度,量取20.00mL待测盐酸溶液的滴定管未用待测盐酸溶液润洗 |
| C.用托盘天平称量10.5g某物质,砝码和药品的位置放反,所称药品的质量 |
| D.配制一定物质的量浓度溶液时,用量筒量取浓溶液的体积时仰视读数,所配溶液的浓度 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
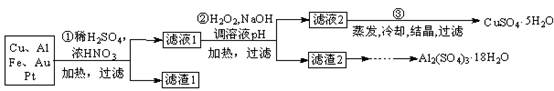

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.进行焰色反应时,必须用稀盐酸洗涤并灼烧铂丝,然后再进行实验 |
| B.分液操作时,分液漏斗中的下层液体从下口放出,上层液体从上口倒出 |
| C.读取滴定管内液体体积时,俯视读数导致读数偏大 |
| D.纸层析法中的展开剂之所以能够展开的主要原理是毛细现象 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.实验室的氯水需要保存在棕色试剂瓶中 |
| B.漂白粉比氯水稳定,可露置在空气中 |
| C.称量氢氧化钠固体时,可在天平两个托盘上各放一张等质量的纸,左边纸上放NaOH,右边纸上放砝码 |
| D.金属钠可保存在煤油、四氯化碳等有机溶剂中 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com