
下列有关物质的性质和应用叙述正确并且有因果关系的是
A.烧碱具有碱性,能用于治疗胃酸过多
B.焦炭具有还原性,一定条件下能将二氧化硅还原为硅
C.浓硝酸具有强氧化性,能和浓氨水反应产生白烟
D.二氧化硫具有漂白性,与氯水混合使用漂白效果更好
科目:高中化学 来源:2013-2014广东省深圳市高三六校4月联考理综化学试卷(解析版) 题型:填空题
(本题16分)降低大气中CO2的含量和有效地开发利用CO2正成为研究的主要课题。
(1)已知在常温常压下:
① 2CH3OH(l) + 3O2(g) = 2CO2(g) + 4H2O(g) ΔH =-1275.6 kJ/mol
② 2CO (g)+ O2(g) = 2CO2(g) ΔH =-566.0 kJ/mol
③ H2O(g) = H2O(l) ΔH =-44.0 kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式: 。
(2)在容积为2L的密闭容器中,充入2mol CO2和6mol H2,在温度500℃时发生反应:
CO2(g)+ 3H2(g) CH3OH(g)+ H2O(g) △H<0。CH3OH的浓度随时间变化如图。回答有关问题:
CH3OH(g)+ H2O(g) △H<0。CH3OH的浓度随时间变化如图。回答有关问题:

①从反应开始到20分钟时,H2的平均反应速率v(H2)=_________________。
②从30分钟到35分钟达到新的平衡,改变的条件可能是 。
A. 增大压强 B.加入催化剂 C.升高温度 D.增大反应物的浓度
③列式计算该反应在35分钟达到新平衡时的平衡常数(保留2位小数)
④如果在30分钟时,再向容器中充入2mol CO2和6mol H2,保持温度不变,达到新平衡时,CH3OH的浓度____________1mol.L-1(填“>”、“<”或“=”)。
(3)一种原电池的工作原理为:2Na2S2 + NaBr3  Na2S4 + 3NaBr。用该电池为电源,以氢氧化钾水溶液作电解质进行电解,使CO2在铜电极上可转化为甲烷。
Na2S4 + 3NaBr。用该电池为电源,以氢氧化钾水溶液作电解质进行电解,使CO2在铜电极上可转化为甲烷。
①该电池负极的电极反应式为: 。
②电解池中产生CH4一极的电极反应式为: 。
(4)下图是NaOH吸收CO2后某种产物的水溶液在pH从0至14的范围内H2CO3、HCO3-、CO32-三种成分平衡时的组成分数。

下列叙述正确的是 。
A.此图是1.0 mol·L-1碳酸钠溶液滴定1.0 mol·L-1 HCl溶液的滴定曲线
B.在pH分别为6.37及10.25时,溶液中c(H2CO3)=c(HCO3-)=c(CO32-)
C.人体血液的pH约为7.4,则CO2在血液中多以HCO3-形式存在
D.若用CO2和NaOH反应制取NaHCO3,宜控制溶液的pH为7~9之间
查看答案和解析>>
科目:高中化学 来源:2013-2014广东省江门市高二调研测试理综化学试卷(解析版) 题型:选择题
在25℃的条件下,下列叙述正确的是
A.将稀氨水逐滴加入稀硫酸中,当溶液的pH=7时,c(SO )= c(NH4+)
)= c(NH4+)
B.pH=3的醋酸溶液,稀释至原体积的10倍后pH=4
C.pH=11的NaOH溶液与pH=3的醋酸溶液等体积混合,溶液pH<7
D.向0.1mol·L-1的氨水中加入少量硫酸铵固体,则溶液中c(OH-) 增大
查看答案和解析>>
科目:高中化学 来源:2013-2014广东省梅州市高一下学期期中化学试卷(解析版) 题型:选择题
下列叙述中错误的是 ( )
A.原子半径:Cl>S>O B.还原性:Na>Mg>Al
C.稳定性:HF>HCl>HBr D. 酸性:HClO4>H2SO4>H3PO4
查看答案和解析>>
科目:高中化学 来源:2013-2014广东省揭阳市高三4月第二次模拟理综化学试卷(解析版) 题型:推断题
(16分)钯/碳高效绿色催化Suzuki 交叉偶联反应是近年来有机合成的热点之一,如反应①:
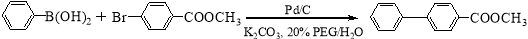
I II
化合物Ⅱ可由化合物III合成:

(1)化合物Ⅱ的分子式为 ,含有的官能团名称为 。
(2)化合物Ⅳ的结构简式为 。
(3)化合物Ⅵ与新制Cu(OH)2悬浊液反应的化学方程式为 (注明条件)。
(4)化合物Ⅴ的一种同分异构体Ⅷ遇FeCl3溶液显紫色,核磁共振氢谱峰面积之比为2:2:2:1,则化合物Ⅷ的结构简式为 _________ 。写出化合物Ⅷ与足量NaOH水溶液反应的化学方程式为 (注明条件)。
(5)化合物 与化合物
与化合物 在一定条件可发生类似反应①的反应,其产物的结构简式为 。
在一定条件可发生类似反应①的反应,其产物的结构简式为 。
查看答案和解析>>
科目:高中化学 来源:2013-2014广东省惠州市高一下学期期末考试化学(理)试卷(解析版) 题型:实验题
某小组同学用下图装置进行实验研究(a、b、c表示止水夹).请评价或完善其方案:
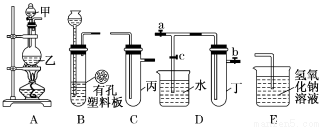
将装置A、C、E相连接,用MnO2和浓盐酸制取氯气,请回答:
①.氯元素在周期表中的位置为 。
②.A中反应的离子方程式:___ _。
③.E中氢氧化钠溶液的作用__________ 。
在C中加入适量的水可制得氯水.将所得氯水分成两份进行实验,其操作、现象和结论为:
实验序号 | 实验操作 | 现象 | 结论 |
Ⅰ | 将氯水滴入品红溶液 | 品红溶液褪色 | 氯气有漂白性 |
Ⅱ | 氯水中加入碳酸氢钠粉末 | 有无色气泡产生 | 氯气与水反应的产物具有酸性 |
④.实验Ⅰ推出的相应结论是否合理? _________,若不合理,请说明理由(若合理,无需填写)________________________________ ______________。
⑤.实验Ⅱ推出相应的结论是否合理?_________,若不合理,请说明理由(若合理,无需填写)____________________________________ ____________________。
(2) 为比较Cl2和I2的氧化性强弱,将A、C、E相连, C中盛的试剂可以为___ _ __。
(3) 将B、D、E相连,在B中装浓硝酸和铜片,可制得NO2并进行有关实验.
①.B中反应的化学方程式_____________________ ______ __________。
②.先若关闭c,当丁中充满红棕色的NO2时,再关闭止水夹a、b ,微热试管丁, 丁中可观察到的实验现象 。
查看答案和解析>>
科目:高中化学 来源:2013-2014广东省惠州市高一下学期期末考试化学(理)试卷(解析版) 题型:选择题
一定条件下,反应2AB(g)  A2(g)+B2(g)达到平衡状态的标志是
A2(g)+B2(g)达到平衡状态的标志是
A.单位时间内生成n molA2的同时消耗n molB2
B.容器内, AB、A2、B2三种气体共存
C.AB的消耗速率等于A2的消耗速率
D.容器中各组分的体积分数不随时间变化
查看答案和解析>>
科目:高中化学 来源:2013-2014广东省惠州市高一下学期期末考试化学(理)试卷(解析版) 题型:选择题
烹鱼时加入少量食醋和料酒可以使烹制的鱼具有特殊的香味,这种香味来自于
A.食盐 B.食醋中的乙酸
C料酒中的乙醇 D.料酒中的乙醇与食醋中的乙酸反应生成的乙酸乙酯
查看答案和解析>>
科目:高中化学 来源:2013-2014广东省广州市越秀区高二下学期期末水平调研化学试卷(解析版) 题型:选择题
某无色溶液中只可能溶有NH4+、K+、Al3+、Mg2+、HCO3-、Cl-、I-、MnO4-、SO42-等离子中的几种离子。为分析其组成,现进行如下实验:
①取10mL该溶液于试管中滴加足量的Ba(NO3)2溶液,加稀硝酸酸化后过滤得到0.03mol白色沉淀甲。
②取上述反应后的滤液,加入AgNO3溶液未见沉淀产生。
③另取10mL该溶液于试管中,滴加NaOH溶液产生白色沉淀乙,当加入NaOH的物质的量为0.03mol时,沉淀的量达到最大;继续滴加NaOH溶液并加热,开始产生气体丙,收集气体丙,换算成标况下为0.224L(假设丙全部逸出),最后沉淀完全溶解。
则下列说法正确的是
A.仅由实验①可推出肯定含有SO42-,不含Cl-
B.该无色溶液肯定含有NH4+、K+、Al3+、SO42-
C.该无色溶液肯定不含K+、Mg2+、HCO3-、Cl-、MnO4-、I-
D.不能确定该无色溶液是否含有K+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com