
分析 (1)先求出盐酸的浓度C=$\frac{1000ρω%}{M}$,然后根据溶液稀释定律C浓V浓=C稀V稀来计算;
(2)根据配制步骤是计算、称量、溶解、冷却、移液、洗涤、定容、摇匀、装瓶来分析需要的仪器;
(3)根据定容的操作来分析;
(4)根据c=$\frac{n}{V}$并结合溶质的物质的量n和溶液的体积V的变化来进行误差分析;
(5)根据c=$\frac{n}{V}$并结合溶质的物质的量n和溶液的体积V的变化来进行误差分析;
(6)根据c=$\frac{n}{V}$并结合溶质的物质的量n和溶液的体积V的变化来进行误差分析.
解答 解:(1)盐酸的浓度C=$\frac{1000ρω%}{M}$=$\frac{1000×1.19×37%}{36.5}$=12.06mol/L,设配制0.1mol/L盐酸溶液500mL需要的浓盐酸的体积为VmL,根据溶液稀释定律C浓V浓=C稀V稀来计算:12.06mol/L×VmL=0.1mol/L×500mL,解得V=4.1mL,故答案为:4.1;
(2)根据配制步骤是计算、称量、溶解、冷却、移液、洗涤、定容、摇匀、装瓶可知需要的玻璃仪器有:烧杯、玻璃棒、胶头滴管、量筒和500mL容量瓶,故答案为:量筒和500mL容量瓶;
(3)定容时,先加水至液面离刻度线1-2cm时,改用胶头滴管逐滴滴入,使溶液的凹液面与刻度线相切即可,故答案为:1-2;溶液的凹面底部正好跟刻度线相切;
(4)若没有洗涤烧杯和玻璃棒,会导致溶质损失,所配溶液浓度偏低,故答案为:偏低;
(5)若容量瓶未干燥即用来配制溶液,对溶液浓度无影响,因为只要定容时正确,至于水是原来就有的还是后来加入的,对浓度无影响,故答案为:无影响;
(6)定容时俯视刻度线,会导致溶液体积偏小,浓度偏大,故答案为:偏高.
点评 本题考查了一定物质的量浓度溶液的配制过程中的计算和误差分析,属于基础型题目,难度不大.


科目:高中化学 来源: 题型:解答题
| 电离能 | I1 | I2 | I3 | I4 | … |
| Im/kJ•mol-1 | 578 | 1 817 | 2 745 | 11 578 | … |
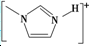 ]BF${\;}_{4}^{-}$的熔点(填>、=或<),其原因是两者均为离子化合物,且电荷数均为1,但后者离子半径大,离子键较弱,因此熔点较低.
]BF${\;}_{4}^{-}$的熔点(填>、=或<),其原因是两者均为离子化合物,且电荷数均为1,但后者离子半径大,离子键较弱,因此熔点较低.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
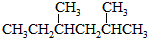 ②
②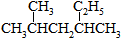 ③CH3CH2CH3
③CH3CH2CH3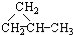 ⑥CH3CH=CHCH3.
⑥CH3CH=CHCH3.| A. | ①和② | B. | ①和③ | C. | ①和④ | D. | ⑤和⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向水中加人稀氨水,平衡逆向移动,c(OH-)降低 | |
| B. | 向水中加入少量固体硫酸氢钠,c(H+)增大,Kw不变 | |
| C. | 向水中加人少量NH4Cl固体,c(OH-)增大 | |
| D. | 将水加热,Kw增大,pH不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 试管、烧杯、表面皿、蒸发皿、圆底烧瓶都能用酒精灯加热 | |
| B. | 用玻璃棒蘸取新制氯水,滴在pH试纸上,然后与比色卡对照,可测定新制氯水的pH值 | |
| C. | 向蛋白质溶液中加入硫酸铜溶液,可以使蛋白质变性 | |
| D. | 用标准NaOH溶液滴定盐酸,滴定管尖嘴部分在滴定前有气泡,滴定终点时无气泡,则测定结果将偏小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 制CO2:大理石+稀硫酸 | B. | 制SO2:Na2SO3(固)+浓硫酸 | ||
| C. | 制H2:Fe(固)+稀硝酸 | D. | 制Cl2:MnO2(固)+稀盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com