
 将1molI2(g)和2molH2置于某2L密闭容器中,在一定温度下发生反应:
将1molI2(g)和2molH2置于某2L密闭容器中,在一定温度下发生反应:分析 (1)平衡时HI体积分数为0.6,反应前后气体总物质的量不变,则平衡时HI为(1mol+2mol)×0.6=1.8mol,根据方程式计算消耗I2(g)的物质的量,进而计算平衡时I2(g)的浓度;
(2)曲线(Ⅰ)与曲线(Ⅱ)相比,到达平衡时间缩短,反应速率加快,平衡时HI体积发生不变,平衡不移动,可能使用催化剂,由于反应前后气体体积不变,也可能是增大压强;
曲线(Ⅲ)与曲线(Ⅱ)相比,到达平衡时更长,反应速率减慢,平衡时HI体积发生不变,平衡不移动,由于反应前后气体体积不变,应是减小压强;
(3)改变物质起始投入量,平衡时HI的体积分数不变,与原平衡为等效平衡,恒温恒容下,反应前后气体体积不变,按化学计量数转化到方程式左边满足与原平衡投料比相同,即满足n(I2):n(H2)=1:2即可.
解答 解:(1)平衡时HI体积分数为0.6,反应前后气体总物质的量不变,则平衡时HI为(1mol+2mol)×0.6=1.8mol,根据方程式可知,算消耗I2(g)的物质的量为1.8mol×$\frac{1}{2}$=0.9mol,故平衡时I2(g)的浓度为$\frac{1mol-0.9mol}{2L}$=0.05mol/L,
故答案为:0.05mol/L;
(2)曲线(Ⅰ)与曲线(Ⅱ)相比,到达平衡时间缩短,反应速率加快,平衡时HI体积发生不变,平衡不移动,可能使用催化剂,由于反应前后气体体积不变,也可能是增大压强,故选:③⑤;
曲线(Ⅲ)与曲线(Ⅱ)相比,到达平衡时更长,反应速率减慢,平衡时HI体积发生不变,平衡不移动,由于反应前后气体体积不变,应是减小压强,故选④,
故答案为:③⑤;④;
(3)改变物质起始投入量,平衡时HI的体积分数不变,与原平衡为等效平衡,恒温恒容下,反应前后气体体积不变,按化学计量数转化到方程式左边满足与原平衡投料比相同,即满足n(I2):n(H2)=1:2即可,即(a+$\frac{1}{2}$c):(b+$\frac{1}{2}$c)=1:2,整理可得:4a+c=2b,
故答案为:4a+c=2b.
点评 本题考查化学平衡计算与影响因素、化学平衡图象,(3)中关键是理解等效平衡规律,侧重考查学生分析计算能力.


科目:高中化学 来源: 题型:选择题
| A. | 氢氧化镁与稀硫酸反应 H++OH-=H2O | |
| B. | 碳酸氢钠溶液与少量石灰水反应HCO3-+Ca2++OH-=CaCO3↓+H2O | |
| C. | 碳酸钙溶于醋酸中:CaCO3+2H+═Ca2++2H2O+CO2↑ | |
| D. | 向NaHSO4溶液逐滴滴加Ba(OH)2溶液至溶液呈中性:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 同温下,等物质的量浓度的A12(SO4)3比MgSO4溶液的pH小,说明镁比铝的金属性强 | |
| B. | 向Na2SiO3溶液中滴人酚酞,溶液变红,再滴加稀盐酸,溶液红色变浅直至消失.证明非金属性:C1>Si | |
| C. | 测定等物质的量浓度的Na2CO3和Na2SiO3溶液的pH,确定碳、硅两元素非金属性的强弱 | |
| D. | 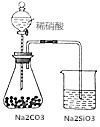 如图锥形瓶中有气体产生,烧杯中液体变浑浊,可证明N、C、Si非金属性依次减弱 如图锥形瓶中有气体产生,烧杯中液体变浑浊,可证明N、C、Si非金属性依次减弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10mol和10% | B. | 20mol和40% | C. | 20mol和20% | D. | 30mol和80% |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学键 | C-C | C-H | C-O | Si-Si | Si-H | Si-O |
| 键能(KJ/mol) | 356 | 413 | 336 | 226 | 318 | 452 |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com