
| A. | 海水蒸发制海盐的过程中只发生了物理变化 | |
| B. | 加入明矾,使海水的盐分沉淀并淡化 | |
| C. | 海水淡化的方法主要有蒸馏法、离子交换法和电渗析法等 | |
| D. | 大海中含有钾、溴、碘等元素,需经过氧化还原反应才可得到钾、溴、碘的单质 |
分析 A.海水蒸发制海盐的过程是物理变化过程;
B.明矾净水利用水解生成的氢氧化铝胶体具有较大表面积吸附悬浮杂质;
C.海水淡化海水就是将海水中的可溶性杂质除去的过程,淡化方法有海水冻结法、电渗析法、蒸馏法、反渗透法\离子交换法等,其中最常用的有蒸馏法、渗析法,海水淡化时使水与盐类物质分离;
D.钾元素化合价由+1价变为0价,溴、碘元素化合价-1价变化为0价,过程中,钾元素得到电子发生还原反应,溴、碘元素失电子发生氧化反应.
解答 解:A.海水蒸发制海盐的过程是物理变化过程,利用了水易挥发的性质进行分离,没有发生化学变化,故A正确;
B.明矾净水利用水解生成的氢氧化铝具有较大表面积,能吸附悬浮杂质起到净水作用,不能使海水的盐分沉淀并淡化,故B错误;
C.海水制淡水主要有蒸馏法、电渗析法、离子交换法等,故C正确;
D.溴元素在海水中以化合态存在,将元素由化合态转化为游离态时发生电子转移,所以一定发生氧化还原反应,故D正确;
故选B.
点评 本题考查了海水资源的开发和利用,根据基本概念结合物质转化方式来分析解答,知道从海水中提取溴的方法,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 原子半径:A<B<C<D<E | |
| B. | D单质能够溶解于C的最高价氧化物对应的水化物 | |
| C. | 金属性:D>C | |
| D. | 化合物AE与CE含有相同类型的化学键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
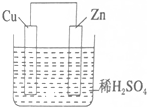 如图是Zn和Cu形成的原电池,某实验兴趣小组做完实验后,在读书卡片上记录如下,其中正确的是( )
如图是Zn和Cu形成的原电池,某实验兴趣小组做完实验后,在读书卡片上记录如下,其中正确的是( )| A. | ①②③⑦ | B. | ②③④⑧ | C. | ③④⑤⑧ | D. | ④⑤⑥⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 放热反应在常温下一定都能发生 | |
| B. | 等质量的石墨与金刚石完全燃烧,金刚石放出的热量多 | |
| C. | 放热反应中,反应物的总能量大于生成物的总能量 | |
| D. | 石墨比金刚石稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
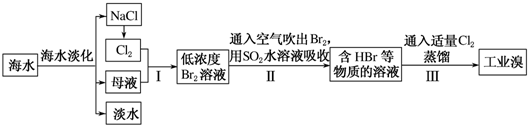
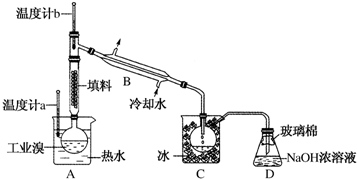
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
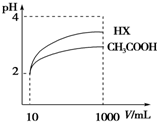 25℃时,电离平衡常数:
25℃时,电离平衡常数:| 化学式 | CH3COOH | H2CO3 | HClO | |
| 电离平衡常数 | 1.8×10-5 | K1 4.3×10-7 K2 5.6×10-11 | 3.0×10-8 | |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com