
 肼(N2H4)和氨是氮的两种常见化合物,在科学技术和生产中有广泛应用.回答下列问题:
肼(N2H4)和氨是氮的两种常见化合物,在科学技术和生产中有广泛应用.回答下列问题: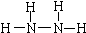 .
.| T/℃ | 165 | 175 | 185 | 195 |
| K | 111.9 | 74.1 | 50.6 | 34.8 |
| n(N2) | n(H2) | n(NH3) | |
| 甲 | 1mol | 3mol | 0mol |
| 乙 | 0.5mol | 1.5mol | 1mol |
| 丙 | 0mol | 0mol | 4mol |
分析 (1)联氨(N2H4)中N原子与其它三个原子成键,达到8电子稳定结构;
(2)实验室常用氯化铵固体与熟石灰固体共热来制取氨气;
(3)NH3与NaClO反应可得到肼(N2H4),N元素的化合价升高,故还生成氯化钠与水;
(4)从作为燃料电池时,负极发生氧化反应的角度可知N2H4被氧化生成N2;
(5)①依据平衡常数随温度变化分析判断反应吸热放热;
②增大反应物浓度,平衡正向进行;依据x含义和图象数据分析结合化学方程式换算氨气转化率;
(6)①根据甲、乙、丙三种方式分别投料形成的平衡不但等效也等同,然后根据甲平衡时各物质的物质的量来判断乙容器中反应进行的方向;
②甲、乙是完全等效平衡,平衡时NH3的体积分数相等,丙相当于在甲平衡的基础上,再加入1molN2、3molH2,压强增大平衡向正反应方向移动,据此解答;
(7)氨气在纯氧中燃烧,生成一种单质和水,由质量守恒可知,应生成氮气,如设计成氨气一氧气燃料电池,在碱性条件下,通入氨气的电极发生氧化反应,生成氮气;
(8)依据化学平衡移动原理结合 反应特征分析判断;
(9)依据溶度积常数计算氢氧根离子浓度,结合氨水电离度概念计算一水合氨溶液的浓度.
解答 解:(1)联氨(N2H4)中N原子与其它三个原子成键,达到8电子稳定结构,结构式为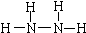 ,故答案为:
,故答案为: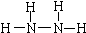 ;
;
(2)制取氨气的反应物是氯化铵与熟石灰,生成物是氯化钙、水和氨气:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2H2O+2NH3↑,
故答案为:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2H2O+2NH3↑;
(3)NH3与NaClO发生氧化还原反应可得到肼(N2H4)、氯化钠和水,所以该反应的化学方程式为:2NH3+NaClO=N2H4+NaCl+H2O,
故答案为:2NH3+NaClO=N2H4+NaCl+H2O;
(4)肼一空气燃料碱性电池中,负极上肼失电子和氢氧根离子反应生成水和氮气,电极反应式为:N2H4+4OH--4e-=4H2O+N2,故答案为:N2H4+4OH--4e-=N2+4H2O;
(5)①平衡常数随温度升高减小,说明正反应为放热反应,△H<0,故答案为:<;
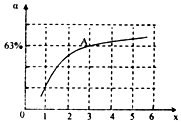
②2NH3 (g)+CO2 (g)?CO(NH2)2 (l)+H2O (l),图象分析判断,增大氨气浓度平衡正向进行,A点处x=3,原料气中的NH3和CO2的物质的量之比为3,二氧化碳转化率为63%,假设氨气为3mol,二氧化碳为1mol,则反应的二氧化碳为0.63mol,
依据化学方程式2NH3(g)+CO2(g)?CO(NH2)2(l)+H2O(l)反应的氨气为1.26mol,
NH3的平衡转化率=$\frac{1.26mol}{3mol}$×100%=42% 故答案为:c(NH3)增大,平衡正向移动; 42%;
(6)①甲、乙、丙三种方式分别投料形成的平衡不但等效也等同,甲容器平衡时N2、H2和NH3的物质的量分别为:0.6mol、1.8mol、0.8mol,则乙容器中反应进行的方向是逆向移动,故答案为:逆向;
②甲、乙是完全等效平衡,平衡时NH3的体积分数相等,丙相当于在甲平衡的基础上,再加入1molN2、3molH2,压强增大平衡向正反应方向移动,氨气的体积分数增大,故体积分数:丙>甲=乙,
故答案为:丙>甲=乙;
(7)氨气在纯氧中燃烧,生成氮气和水,化学方程式为:4NH3+5O2$\frac{\underline{\;点燃\;}}{\;}$2N2+6H2O,在燃料电池中,燃料做负极,则通入氨气的电极是负极,碱性条件下,该电极发生反应的电极反应式为2NH3-6e-+6OH-=N2+6H2O,
故答案为:4NH3+5O2$\frac{\underline{\;点燃\;}}{\;}$2N2+6H2O;负极;2NH3-6e-+6OH-=N2+6H2O;
(8)4NH3(g)+5O2(g)?4NO(g)+6H2O(g).在一定体积的密闭容器中,为使该反应的反应速率增大,且平衡向正反应方向移动,
a.反应是气体体积增大的反应,增大压强,反应速率增大,平衡逆向进行,故a不符合;
b.反应是放热反应,适当升高温度,反应速率增大,平衡逆向进行,故b不符合;
c.增大O2的浓度,平衡正向进行,反应速率增大,故c符合;
d.选择高效催化剂只能改变化学反应速率,但不改变化学平衡,故d不符合;
故答案为:c;
(9)如果某氨水的电离程度为1%,浓度为0.01mol/LMgCl2溶液滴加氨水至开始产生沉淀时(不考虑溶液体积变化),{已知Ksp[Mg(OH)2]=4.0×10-12]},则依据溶度积常数计算:Ksp=c(Mg2+)×c2(OH-)=4.0×10-12 ,c(Mg2+)=0.01mol/L,c(OH-)=2×10-5mol/L,氨水的浓度=$\frac{2×1{0}^{-5}mol/L}{1%}$=0.002mol/L,
故答案为:0.002 mol/L.
点评 本题考查了原电池原理和电极反应书写应用,影响化学平衡因素分析判断,弱电解质和溶度积常数的计算理解,掌握基础是关键,题目难度中等.


科目:高中化学 来源: 题型:解答题
 铜版画的一种制版方法.以沥青涂于薄铜板表面作防腐膜,用刀刻去防腐膜作画,然后放在FeCl3腐蚀液中.刮去膜之处被腐蚀,形成凹线.印刷时凹线可储油墨,在铜版机纸压制下油墨吸于纸上,形成典雅、庄重的铜版画.
铜版画的一种制版方法.以沥青涂于薄铜板表面作防腐膜,用刀刻去防腐膜作画,然后放在FeCl3腐蚀液中.刮去膜之处被腐蚀,形成凹线.印刷时凹线可储油墨,在铜版机纸压制下油墨吸于纸上,形成典雅、庄重的铜版画.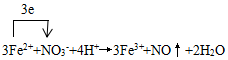 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属性:Na>Mg | B. | 酸性:H2SO4>H2SiO3 | ||
| C. | 稳定性:HCl>HBr | D. | 同浓度溶液的碱性:Na2CO3>NaHCO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

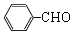 +O2$→_{△}^{催化剂}$2
+O2$→_{△}^{催化剂}$2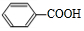 .
. +
+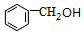 $?_{△}^{浓硫酸}$
$?_{△}^{浓硫酸}$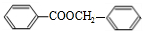 +H2O.
+H2O.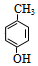 .
.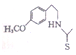 也能发生类似反应④的环化反应,VII的环化产物的结构简式
也能发生类似反应④的环化反应,VII的环化产物的结构简式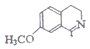 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,11.2LCH4含有5NA个电子 | |
| B. | 标准状况下,22.4L氦气含有2NA个原子 | |
| C. | 常温常压下,22.4L CO2和SO2混合气体含有2NA个氧原子 | |
| D. | 46gNO2和N2O4的混合气体含氮原子数为NA个 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com