
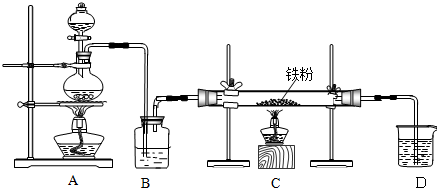
分析 (1)实验室制备无水氯化铁:A装置:烧瓶中反应MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,制取的氯气中含有水蒸气,B装置:容器中装有浓硫酸,浓硫酸有吸水性,且不和氯气反应,用浓硫酸干燥氯气;C装置:氯气与铁在加热条件下生成氯化铁,反应方程式为:2Fe+3Cl2$\frac{\underline{\;\;△\;\;}}{\;}$2FeCl3,氯气有毒不能排放到空气中,D装置:吸收尾气氯气,Cl2+2NaOH═NaCl+NaClO+H2O,防止污染空气.实验室利用二氧化锰与浓盐酸加热反应制取氯气,浓硫酸可以干燥氯气;
(2)制取无水氯化亚铁,需要HCl气体,尾气的成分是剩余HCl和生成的氢气,HCl极易溶解于水,氢气不能溶于水;
(3)检验氯化铁常用硫氰化钾溶液,若要制取纯净的FeCl2,需先点燃A处的酒精灯排除装置中的空气,据此解答即可.
解答 解:(1)制取无水氯化铁的实验中,A装置制取的是氯气,实验室常用浓盐酸与二氧化锰加热制取,化学反应方程式为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,制取的氯气中含有水蒸气,装置B的作用是干燥氯气,常用浓硫酸,
故答案为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;浓硫酸;
(2)制取无水氯化亚铁,需要HCl气体,故A装置制取的是HCl,反应方程式为:Fe+2HCl$\frac{\underline{\;\;△\;\;}}{\;}$FeCl2+H2,故尾气的成分为未反应的HCl和生成的氢气,由于HCl极易溶于水,故若仍然采用D装置进行尾气处理,很容易造成倒吸,且氢气不溶于水,不利于氢气的吸收,氢气易燃,造成安全隐患,
故答案为:HCl;HCl和H2;发生倒吸;可燃性气体H2不能被吸收;
(3)检验氯化铁常用硫氰化钾溶液,若要制取纯净的FeCl2,需先排净装置中的空气,防止在加热时Fe与O2反应,故先点燃A处的酒精灯,再点燃C处的酒精灯,
故答案为:KSCN溶液;A;排出装置中的空气,防止在加热时Fe与O2反应.
点评 本题以氯化铁以及氯化亚铁的制取为载体,考查的是实验室中氯气的制取方法、常见尾气的处理方法以及铁离子的检验等,题目难度中等.


科目:高中化学 来源: 题型:解答题
 对叔丁基苯酚
对叔丁基苯酚 工业用途广泛,可用于生产油溶性酚醛树脂、稳定剂和香料等.实验室以苯酚、叔丁基氯[(CH3)3CCl]等为原料制备对叔丁基苯酚.实验步骤如下:反应物和产物的相关数据列表如下:
工业用途广泛,可用于生产油溶性酚醛树脂、稳定剂和香料等.实验室以苯酚、叔丁基氯[(CH3)3CCl]等为原料制备对叔丁基苯酚.实验步骤如下:反应物和产物的相关数据列表如下: .该反应过于激烈,放出大量热,常使实验的产率降低,可能的原因是由于叔丁基氯挥发导致产率降低.
.该反应过于激烈,放出大量热,常使实验的产率降低,可能的原因是由于叔丁基氯挥发导致产率降低.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 名称 | 托盘天平(带砝码) | 小烧杯 | 坩埚钳 | 玻璃棒 | 药匙 | 量筒 |
| 仪器 |  |  |  |  |  |  |
| 序号 | a | b | c | d | e | f |

| 实验次数 温度 | 起始温度t1/℃ | 终止温度t2/℃ | 平均温度差(t2-t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 30.1 | |
| 2 | 27.0 | 27.4 | 27.2 | 33.3 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.8 | |
| 4 | 26.4 | 26.2 | 26.3 | 30.4 | |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 能使淀粉碘化钾试纸显蓝色的溶液:K+、SO42-、S2-、SO32- | |
| B. | 有NO3-存在的强酸性溶液中:NH4+、Ba2+、Fe2+、Br- | |
| C. | 碳酸氢钠溶液中:K+、ClO-、Cl-、OH- | |
| D. | 使酚酞变红的溶液中:CO32-、Na+、AlO2-、NO3-、S2-、SO32- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com