
����Ŀ��������أ�K2FeO4����һ�ָ�Ч��ˮ������֪��K2FeO4������ˮ������ŨKOH��Һ�������Ի�������Һ�в��ȶ�����0��5����ǿ������Һ�н��ȶ���ijʵ��С�����Ʊ�������ز��ⶨ�䴿�ȡ�
��.�Ʊ�������أ��г�װ���ԣ�
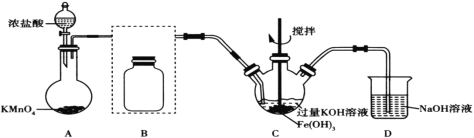
��1��װ��AΪ��������װ�ã�����ʢ�Ÿ�����ص���������Ϊ__��
��2��������װ��B�������������������Լ�__��
��3��װ��C��Cl2��Fe(OH)3��KOH��Ӧ����K2FeO4�Ļ�ѧ����ʽ��____��
��4��ʵ��ʱ��װ��C���ڱ�ˮԡ�У���ԭ����____��
��5��ʵ��ᾧ���õ���K2FeO4�����Ժ��϶����ʣ�Ҫ�õ������ľ��壬��Ӧ��ȡ�IJ���������____��
��.�ⶨ��Ʒ����
��6����wg K2FeO4�ֲ�Ʒ���ڹ����ļ����Ǹ�������Һ�У���ַ�Ӧ����ϡ�����ữ��pHΪ2�������õ��ظ�������Һ�м���5�ζ�������������Һ��ָʾ����Ȼ����c mol��L1(NH4)2Fe(SO4)2����Һ�ζ����յ㣬���ı���ҺVmL����֪�ù������漰�����ӷ�Ӧ��Ҫ��������
��Cr(OH)4+ FeO42-=Fe(OH)3��+CrO42-+OH��
��_______��
��Cr2O72-+6Fe2++ 14H+=6Fe3+ +2Cr3+ +7H2O��
�ôֲ�Ʒ��K2FeO4����������Ϊ__���ú�w��c��V�Ĵ���ʽ��ʾ�������ζ���û���ñ�Һ��ϴ�����õĽ��__���ƫ�ߡ���ƫ�͡�����Ӱ�족����
���𰸡�Բ����ƿ  3Cl2��2Fe(OH)3��10KOH=2K2FeO4��6KCl��8H2O K2FeO4��0��5�滷���н��ȶ�����ֹ����Ӧ���� �ؽᾧ 2CrO42����2H��
3Cl2��2Fe(OH)3��10KOH=2K2FeO4��6KCl��8H2O K2FeO4��0��5�滷���н��ȶ�����ֹ����Ӧ���� �ؽᾧ 2CrO42����2H��![]() Cr2O72����H2O
Cr2O72����H2O ![]() ��
��![]() ��
��![]() ƫ��
ƫ��
��������
������Ũ�����KMnO4�Ʊ�Cl2���Ʊ���Cl2������HCl����Ҫ�ñ���ʳ��ˮ���ӣ�Cl2��Fe(OH)3��KOH��Ӧ����K2FeO4������NaOH��Һ���������Cl2��
(1)���������Ľṹ����֪������ΪԲ����ƿ��
(2)װ��B�������dz�ȥCl2�е�HCl��ѡ�ñ���ʳ��ˮ��װ����ͼ��ʾ ��
��
(3)Cl2��Cl�Ļ��ϼ۽��ͣ���0���͵���1��������2�ۣ�Fe(OH)3��Fe�Ļ��ϼ����ߣ��ӣ�3���ߵ���6�����ϼ������غ㣬��Cl2��Fe(OH)3��ϵ����Ϊ3��2���ٸ���ԭ���غ���ƽ����ѧ����ʽΪ3Cl2��2Fe(OH)3��10KOH=2K2FeO4��6KCl��8H2O��
(4)����K2FeO4��0��5����ǿ������Һ�н��ȶ�����˽�װ��C���ڱ�ˮԡ����K2FeO4��0��5�������н��ȶ�����ֹ����Ӧ������
(5)K2FeO4������ˮ�У��ᾧ���K2FeO4�к��н϶����ʣ����������ؽᾧ�ᴿ��
��(6)���ݷ�Ӧ�ٺۣ͢�����H2SO4�ữ��Ӧ���еIJ���CrO42��ת��ΪCr2O72�������ӷ���Ϊ2CrO42����2H��Cr2O72����H2O��
���ݷ�Ӧ����ʽ���ɵù�ϵʽK2FeO4��CrO42����![]() Cr2O72����3Fe2����n(K2FeO4)=
Cr2O72����3Fe2����n(K2FeO4)=![]() n[(NH4)2Fe(SO4)2]=
n[(NH4)2Fe(SO4)2]=![]() ��cV��10��3mol��m(K2FeO4)=
��cV��10��3mol��m(K2FeO4)=![]() ��cV��10��3mol��198g��mol��1=0.066cVg����K2FeO4����������Ϊ
��cV��10��3mol��198g��mol��1=0.066cVg����K2FeO4����������Ϊ![]() ��
��
����ζ���û���ñ�Һ��ϴ����ô���ĵı�Һ����������ӣ�����õ�K2FeO4�����������ӣ���������ƫ�ߡ�


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����
A.�����£���![]() �Ĵ�����Һϡ�͵�ԭ�����10������Һ��
�Ĵ�����Һϡ�͵�ԭ�����10������Һ��![]()
B.�����£���NaHA��Һ��![]() ����
����![]() ������
������
C.���������Һ�ζ���ˮ������ʱ��![]() δ����ȫ�к�
δ����ȫ�к�
D.![]() ʱ
ʱ![]() ��Һ��
��Һ��![]() ����
����![]() ʱNaCl��Һ��
ʱNaCl��Һ��![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ҫ��ش��������⣺
��1�������������ʣ���NaCl���� ��Һ̬HCl ��CaCO3���� ������KCl ������ ��ͭ ��CO2 ��H2SO4 ��KOH����
a. �����������ܵ������________________________________��
b. �������������ڵ���ʵ���_______________________�����ڷǵ���ʵ���_______________________��
c. ���������У�����ˮ���ܵ����������_______________________��
��2���������Һ�ı���������________________�����������Һ�����õķ����ǹ۲��Ƿ��ܷ���___________ЧӦ��
��3������3����Ӧ����Ҫ����д�������
��2Na2O2+2H2O��4NaOH+ O2����Ӧ�У�ÿ����1 mol Na2O2����_____ g O2��
����NaHCO3���ȷֽⷴӦ�У�ÿ����168 g NaHCO3����״��������_____L CO2��
��Cl2+H2O��HCl+HClO��Ӧ�У���״����ÿ����22.4LCl2��ת��_____mol���ӡ�
��4����һ���ܱ������з��������������ʣ���һ�������·�����ѧ��Ӧ��һ��ʱ�����й��������£�
���� | M | N | Q | P |
��Ӧǰ������g�� | 50 | 1 | 3 | 12 |
��Ӧ��������g�� | x | 26 | 3 | 30 |
�ٸñ仯�Ļ�����Ӧ������_____��Ӧ��
������Q�ڷ�Ӧ�����������_____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ѧ��ȤС���ͬѧ�������ͼ��ʾ��װ�ã�����������⣺
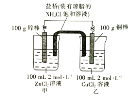
��1����Ӧ�����У�______���������ӡ�
��2���ܷ�Ӧ�����ӷ���ʽΪ_____��
��3����Ӧ�У�������һ���缫������Ϊ102gʱ����һ�缫����______________������ڡ�С�ڻ���ڣ�98g��
��4����Ӧ�����У������е�________ ���ӽ���ױ���
��5�������·��ת��0.2mol����ʱ�����ձ���Ũ��������������_________�������ʵ���Ũ��Ϊ_______________����������Һ������䣩
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��(1)12.4 g Na2R��Na��0.4 mol����Na2R��Ħ������Ϊ________��R�����ԭ������Ϊ________����R������Ϊ1.6 g��Na2R�������ʵ���Ϊ________��
(2)86.4gA������4.80molCl2��ȫ��Ӧ������3.20molAClx,��x=___________��A��Ħ������Ϊ__________________g��mol-1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪A��һ�ֳ�����һ�ֽ�����F��һ�ֺ��ɫ�ij������Ը���ͼ��ת����ϵ���ش��������⡣
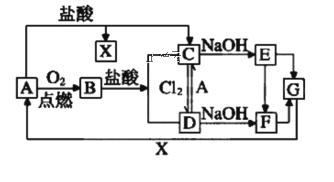
��1��д��A��B��D��E�Ļ�ѧʽ��A___��B___��D___��E___��
��2������D�������ӵķ�����___��
��3������C��ҺʱΪʲô�ӹ���A___��
��4��д������ת�������ӷ���ʽ
��C��E___��
��A��C___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��H3AsO3��һ�־綾��ɼ������SnCl2����ȥ����Ӧ����ʽΪ��2H3AsO3+3SnCl2+12X=2As��+3H2SnCl6+6H2O�����й��ڸ÷�Ӧ��˵������ȷ���ǣ� ��
A.��ԭ����H3AsO3
B.X�Ļ�ѧʽΪHCl���Ǹ÷�Ӧ��������
C.ÿ����0.2molAs����ԭ���õ�0.6mol����
D.�÷�Ӧת��2mol���ӣ����������SnCl2Ϊ1mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���밴Ҫ������
(1)����ݹ����ŵIJ�ͬ�������л�����з��ࣺ
�� ![]() ��
�� ![]() ��
�� ![]() ��
�� ![]()
�� ![]() ��
��![]() ��
��![]()
��.�ӣ�________ͪ��________ȩ��________(�����)��
��.�ܵĹ����ŵ�����Ϊ______���ߵĹ����ŵ�����Ϊ______��
(2)����ʽΪC4H8������ϩ�����л����ͬ���칹�壨������˳���칹���� ____�֣� �߾���ĵ���Ľṹ��ʽ��_________��
�߾���ĵ���Ľṹ��ʽ��_________��
(3)![]() ������Ϊ��_____________��д��
������Ϊ��_____________��д��![]() �ۺ����ɸ߷��ӻ�����Ļ�ѧ����ʽ__________________________________��
�ۺ����ɸ߷��ӻ�����Ļ�ѧ����ʽ__________________________________��
(4)����ʽ![]() ��ʾ�ķ���ʽΪ___________�����以Ϊͬ���칹����һ�ȴ��������ֵ����Ľṹ��ʽ____________________��
��ʾ�ķ���ʽΪ___________�����以Ϊͬ���칹����һ�ȴ��������ֵ����Ľṹ��ʽ____________________��
(5)������ӵĽṹ��ͼ��ʾ��
![]()
������ķ���ʽΪ��________,��һ�ȴ�����______�֣�
����ʹ1mol������������ԭ��ȫ������ԭ��ȡ������Ҫ_____mol������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��PbCrO4��һ�ֻ�ɫ���ϣ��Ʊ�PbCrO4��һ��ʵ�鲽����ͼ1��
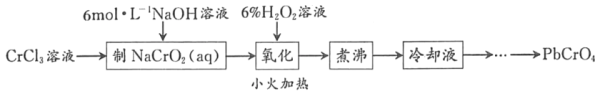
��֪����Cr��OH��3�����������������ɫ��������ˮ
��Pb��NO3��2��Pb��CH3COO��2��������ˮ��PbCrO4��KspΪ2.8��10��13��Pb��OH��2��ʼ����ʱpHΪ7.2����ȫ����ʱpHΪ8.7��
�����۸�����Һ�����ֲַ�������pH��ϵ��ͼ2��ʾ��
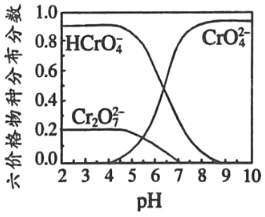
��PbCrO4���ɷ��ڵĸ�������Һ��Ǧ����Һ�����Ƶã���PbCrO4����ʱ��������
��1��ʵ��ʱ��Ҫ����100mL3molL��1CrCl3��Һ��������Ͳ�����������ձ�������Ҫ����������___��
��2������NaCrO2��aq����ʱ������NaOH��Һ�������IJ���������_____��
��3����������ʱH2O2�μ��ٶȲ��˹��죬��ԭ����_____����������ʱ������Ӧ�����ӷ���ʽΪ___��
��4�����������Ŀ����_____��
��5�������������ȴҺ���Ʊ�PbCrO4��ʵ�������_____[ʵ������ʹ�õ��Լ��У�6molL��1�Ĵ��ᣬ0.5molL��1Pb��NO3��2��Һ��pH ��ֽ]��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com