
| 选项 | 离子方程式 | 结论 |
| A | AgCl(s)+I-(aq)═AgI(s)+Cl-(aq) | 溶解度:AgI>AgCl |
| B | Fe2++H2O2+2H+═Fe3++2H2O | 氧化性:H2O2>Fe3+ |
| C | CO32-+CO2+H2O═2HCO3- | 稳定性:HCO3->CO32- |
| D | NH3+H3O+═NH4++H2O | 得质子能力:NH3>H2O |
| A、A | B、B | C、C | D、D |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
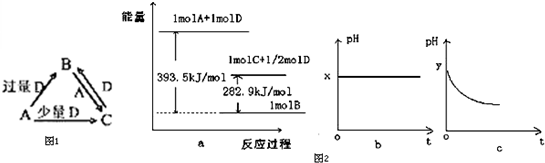
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 五种短周期主族元素在周期表中处于图示位置关系,下列有关叙述正确的是( )
五种短周期主族元素在周期表中处于图示位置关系,下列有关叙述正确的是( )| A、Q的气态氢化物化学式为H2Q |
| B、Q的气态氢化物化学式为H3Q |
| C、X的最高正价与负极的绝对值相差4 |
| D、M是非金属性最强的元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、 用排饱和食盐水法收集氯气,瓶内装饱和食盐水,氯气从①口进,②口出 |
B、 该装置中橡皮管的作用是能使水顺利流下 |
C、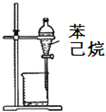 除去苯中的己烷 |
D、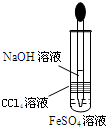 制备Fe(OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向铁粉中加入足量稀硝酸:2Fe+6H+═2Fe3++3H2↑ |
| B、向AlCl3溶液中滴加浓氨水至过量:Al3++4OH-═AlO2-+2H2O |
| C、向NaIO3溶液中加入适量NaHSO3溶液:IO3-+3HSO3-═I-+3SO42-+3H+ |
| D、向NH4HCO3溶液中滴加过量NaOH溶液:NH4++HCO3-+2OH-═CO32-+NH3?H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、239Pu比235U原子核内多4个中子 |
| B、核反应堆中使用的重水与水互为同位素 |
| C、石油、天然气等化石燃料属于可再生能源 |
| D、合理使用核能可有效减少温室气体的排放 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com