
【题目】我国农业因遭受酸雨而造成的损失每年高达15亿多元,为了有效控制酸雨,目前国务院已批准了《酸雨控制区和二氧化硫污染控制区划分方案》等法规。
(1)现有雨水样品1份,每隔一段时间测定该雨水样品的pH所得数据如下:
测试时间/h | 0 | 1 | 2 | 3 | 4 |
雨水的pH | 4.75 | 4.62 | 4.56 | 4.55 | 4.54 |
分析数据,回答以下问题:
①雨水样品呈酸性的原因是________________________________(用化学方程式表示)。
②如果将刚取样的上述雨水和自来水(含有氯气)混合,pH将________(填“变大”“变小”或“不变”)。
(2)测定雨水样品时,每隔一定时间测定一次pH,发现pH逐渐变小,其原因可能是_______(用化学方程式表示)。
(3)举一例说明这种雨水将给环境中的生物或非生物造成的影响________________。
【答案】SO2+H2O![]() H2SO3 变小 2H2SO3+O2==2H2SO4 酸雨可腐蚀金属、建筑物,破坏植物,污染湖泊导致大量鱼类及水生生物死亡(任选1例,其它合理答案均可)
H2SO3 变小 2H2SO3+O2==2H2SO4 酸雨可腐蚀金属、建筑物,破坏植物,污染湖泊导致大量鱼类及水生生物死亡(任选1例,其它合理答案均可)
【解析】
正常雨水中,CO2+H2O![]() H2CO3,由于碳酸显酸性,所以正常雨水显酸性,且pH大约为5.6。当雨水中溶入一定量SO2后,SO2与水反应生成亚硫酸,从而使雨水的酸性增强,pH减小。当pH<5.6,雨水这就成为酸雨。在酸雨中,H2SO3易被空气中的氧气氧化为硫酸,导致酸性增强,pH减小。
H2CO3,由于碳酸显酸性,所以正常雨水显酸性,且pH大约为5.6。当雨水中溶入一定量SO2后,SO2与水反应生成亚硫酸,从而使雨水的酸性增强,pH减小。当pH<5.6,雨水这就成为酸雨。在酸雨中,H2SO3易被空气中的氧气氧化为硫酸,导致酸性增强,pH减小。
(1)①雨水样品呈酸性,主要是SO2溶于水并与水反应,原因是SO2+H2O![]() H2SO3。答案为:SO2+H2O
H2SO3。答案为:SO2+H2O![]() H2SO3;
H2SO3;
②如果将刚取样的上述雨水和自来水(含有氯气)混合,则会发生反应H2SO3+Cl2+H2O==H2SO4+2HCl,pH将变小。答案为:变小;
(2)测定雨水样品时,每隔一定时间测定一次pH,发现pH逐渐变小,主要是H2SO3被空气中O2氧化所致,其原因可能是2H2SO3+O2==2H2SO4。答案为:2H2SO3+O2==2H2SO4;
(3)举一例说明这种雨水将给环境中的生物或非生物造成的影响酸雨可腐蚀金属、建筑物,破坏植物,污染湖泊导致大量鱼类及水生生物死亡(任选1例,其它合理答案均可)。答案为:酸雨可腐蚀金属、建筑物,破坏植物,污染湖泊导致大量鱼类及水生生物死亡(任选1例,其它合理答案均可)。


科目:高中化学 来源: 题型:
【题目】下列事实不能用勒夏特列原理解释的是 ( )
A.氯水中有平衡:Cl2+H2O![]() HCl+HClO,当加入AgNO3溶液后,溶液颜色变浅
HCl+HClO,当加入AgNO3溶液后,溶液颜色变浅
B.对CO(g)+NO2(g)![]() CO2(g)+NO(g),平衡体系增大压强可使颜色变深
CO2(g)+NO(g),平衡体系增大压强可使颜色变深
C.对2NO2(g)![]() N2O4(g), 升高温度平衡体系颜色变深
N2O4(g), 升高温度平衡体系颜色变深
D.SO2催化氧化成SO3的反应,往往加入过量的空气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钒及其化合物在工业上有许多用途。某钒精矿的主要成分及质量分数如下表:
物质 | V2O5 | V2O3 | K2O | SiO2 | Fe2O3 | Al2O3 |
质量分数% | 0.81 | 1.70 | 2.11 | 63.91 | 5.86 | 12.51 |
一种从该钒精矿中提取五氧化二钒的流程如下:
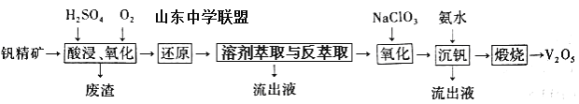
回答下列问题:
(1)“酸浸、氧化”时,V2O3转化为VO2+,反应的离子方程式为____________________________________;若用浓盐酸代替硫酸,V2O5转化为VO2+,同时生成有毒的黄绿色气体,反应的化学方程式为__________________。
(2)萃取剂对四价钒具有高选择性,且萃取Fe3+而不萃取Fe2+,所以萃取前可用____________(填名称,下同)对浸出液进行“还原”处理。为检验“还原”后的滤液中是否含有Fe3+,可选用的化学试剂是____________________。
(3)“溶剂萃取与反萃取”可表示为:VO2+ + (HR2PO4)2(O)![]() VO(R2PO4)2(O)+ 2H+。其中(HR2PO4)2(O)为萃取剂,为了提高VO2+的产率,反萃取剂应该呈 __________性(填“酸”“碱”或“中”)。
VO(R2PO4)2(O)+ 2H+。其中(HR2PO4)2(O)为萃取剂,为了提高VO2+的产率,反萃取剂应该呈 __________性(填“酸”“碱”或“中”)。
(4)“氧化”中,欲使3molVO2+变为VO2+,则需要氧化剂NaClO3至少为____________mol。
(5)单质钒可用于制造特种合金钢。以五氧化二钒和金属钙为原料在高温条件下可制备单质钒,表示制备过程的化学方程式为________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用煤油作溶剂,二(2-乙基己基)磷酸酯作流动载体,H2SO4 作内相酸处理含铜废水。 在其他条件相同时,Cu2+萃取率[萃取率= ×100% ]与初始 Cu2+浓度关系如图 1 所示;在其他条件相同时,处理前初始 Cu2+浓度为 200 mg·L-1,Cu2+萃取率与废水 pH 的关系如图 2 所示。下列说法错误的是
×100% ]与初始 Cu2+浓度关系如图 1 所示;在其他条件相同时,处理前初始 Cu2+浓度为 200 mg·L-1,Cu2+萃取率与废水 pH 的关系如图 2 所示。下列说法错误的是
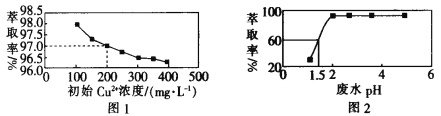
A.根据图 1 可知,废水中初始 Cu2+浓度越大,Cu2+的萃取效果越好
B.根据图 2 可知,废水初始 pH>2 时,去除 Cu2+的效果较好
C.根据图 1 可知,Cu2+初始浓度为 200 mg·L-1 时,Cu2+的萃取率为 97.0%
D.根据图 2 可知,若取 800 mL 初始 Cu2+浓度为 200 mg·L-1 的废水,在 pH=1.5 时处理废水,则处理后的废水中剩余 Cu2+的物质的量为 1.5×10-3mol(假设体积不变)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】垃圾的分类收集是实现垃圾处理无害化、减量化和资源化的重要措施。向贴有如下图所示标志的垃圾箱中丢弃的垃圾应是

A.厨房垃圾B.可回收垃圾C.有害垃圾D.其他垃圾
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国重晶石(含BaSO490%以上)资源丰富,其中贵州省重晶石储量占全国总储量的三分之一。我省某工厂以重晶石为原料,生产“电子陶瓷工业支柱”——钛酸钡(BaTiO3)的工艺流程如下:

查阅资料可知:
①常温下: Ksp(BaSO4)=1.0×10-10,Ksp(BaCO3)=2.5×10-9
②TiC14在常温下是无色液体,遇水容易发生水解:TiCl4+2H2O=TiO2+4HCl。
③草酸氧钛钡的化学式为:BaTiO(C2O4)2·4H2O。
请回答下列问题:
(1)工业上用饱和Na2CO3溶液处理重晶石(假设杂质不与Na2CO3溶液作用),待达到平衡后,移走上层清液,重复多次操作,将BaSO4转化为易溶于酸的BaCO3,该过程用离子方程式可表示为___________,此反应的平衡常数K=____ (填写计算结果)。若不考虑CO32- 的水解,则至少需要使用_____mol/L 的Na2CO3溶液浸泡重晶石才能实现该转化过程。
(2)酸浸时所发生反应的离子方程式为___________________________________。
(3)配制TiCl4溶液时通常将TiCl4固体溶于浓盐酸再加水稀释,其目的是_____________________。
(4)可循环使用的物质X 是_________(填化学式),设计实验方案验证草酸氧钛钡晶体是否洗涤干净:_____________________________________________________________。
(5)煅烧草酸氧钛钡晶体得到BaTiO3的同时,高温下生成的气体产物有CO、__________和_________(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ClO2(黄绿色易溶于水的气体)是一种高效、低毒的消毒剂。某兴趣小组通过图1装置(夹持装置略)对其制备、吸收和释放进行了研究。
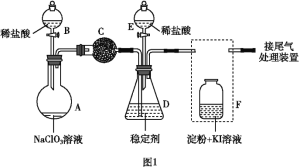
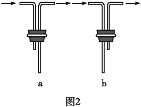
(1)仪器A的名称是_______________________。
(2)安装F中导管时,应选用图2中的___________________。
(3)A中发生反应生成ClO2和Cl2,其氧化产物和还原产物物质的量之比为__________。
(4)关闭B的活塞,ClO2在D中被稳定剂完全吸收生成NaClO2,此时F中溶液的颜色不变,则装置C的作用是__________________。
(5)已知在酸性条件下NaClO2可发生反应生成NaCl并释放出ClO2,该反应的离子方程式为____。
(6)ClO2很不稳定,需随用随制,产物用水吸收可得到ClO2溶液。为测定所得溶液中ClO2的浓度,进行了下列实验:
步骤1:准确量取ClO2溶液10.00mL,稀释成100.00mL试样,量取V0 mL试样加入到锥形瓶中;
步骤2:用稀硫酸调节试样的pH≤2.0,加入足量的KI晶体,静置片刻;
步骤3:加入指示剂,用c mol·L1 Na2S2O3溶液滴定至终点。重复2次,测得消耗Na2S2O3溶液平均值为V1 mL。
(已知2ClO2+10I+8H+=2Cl+5I2+4H2O 2Na2S2O3+I2![]() Na2S4O6+2NaI)
Na2S4O6+2NaI)
计算该ClO2的浓度为______g/L(用含字母的代数式表示,计算结果化简)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SO2和氮氧化物的转化和综合利用既有利于节约资源,又有利于保护环境。
(1)H2还原法是处理燃煤烟气中SO2的方法之一。已知:
2H2S(g)+SO2(g)=3S(s)+2H2O(l) ΔH=a kJ·mol—1
H2S(g)=H2(g)+S(s) ΔH=b kJ·mol—1
H2O(l)=H2O(g) ΔH=c kJ·mol—1
写出SO2(g)和H2(g)反应生成S(s)和H2O(g)的热化学方程式:____________。
(2)SO2经过净化后与空气混合进行催化氧化可制取硫酸,其中SO2发生催化氧化的反应为:2SO2(g)+O2(g)![]() 2SO3(g)。若在T1℃、0.1 MPa条件下,往一密闭容器通入SO2和O2[其中n(SO2) ∶n(O2)=2∶1],测得容器内总压强与反应时间如图所示。
2SO3(g)。若在T1℃、0.1 MPa条件下,往一密闭容器通入SO2和O2[其中n(SO2) ∶n(O2)=2∶1],测得容器内总压强与反应时间如图所示。

①图中A点时,SO2的转化率为____________。
②在其他条件不变的情况下,测得T2℃时压强的变化曲线如图所示,则C点的正反应速率vc(正)与A点的逆反应速率vA(逆)的大小关系为vc(正)______vA(逆)(填“>”、“<”或“=”)。
③图中B点的压强平衡常数Kp=_______________(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(3)利用脱氮菌可净化低浓度NO废气。当废气在塔内停留时间均为90s的情况下,测得不同条件下NO的脱氮率如图Ⅰ、Ⅱ所示。

①由图I知,当废气中的NO含量增加时,宜选用_________法提高脱氮效率。
②图Ⅱ中,循环吸收液加入Fe2+、Mn2+提高了脱氮的效率,其可能原因为____________。
⑷研究表明:NaClO2/H2O2酸性复合吸收剂可同时有效脱硫、脱硝。图Ⅲ所示为复合吸收剂组成一定时,温度对脱硫脱硝的影响。
①写出废气中的SO2与NaClO2反应的离子方程式:____________________________。
②温度高于60℃后,NO去除率随温度升高而下降的原因为_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在室温下,下列五种溶液:
①0.1 mol·L-1 NH4Cl ②0.1 mol·L-1 CH3COONH4 ③0.1 mol·L-1 NH4HSO4 ④0.1 mol·L-1 NH3·H2O和0.1 mol·L-1 NH4Cl混合液 ⑤0.1 mol·L-1 NH3·H2O
请根据要求填写下列空白:
(1)溶液①呈___(填“酸”“碱”或“中”)性,其原因是____________(用离子方程式表示)。
(2)比较溶液②③中c (NH4+)②____________③(填“>”、“<”或“=”)
(3)在溶液④中,___的浓度为0.1 mol·L-1(填选项);NH3·H2O和_____离子的浓度之和为0.2 mol·L-1。(填选项)
A .c (NH4+) B. c (Cl-)
(4)室温下,测得溶液②的pH=7,则说明CH3COO-的水解程度___NH4+的水解程度,(填“>”“<”或“=”),c(CH3COO-)_____ c(NH4+) (填“>”“<”或“=”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com